The hippocampal sparing subtype of Alzheimer’s disease assessed in neuropathology and in vivo tau positron emission tomography: a systematic review.
Ferreira, Daniel, et al.
Acta Neuropathologica Communications 10.1 (2022): 1-19.
1. 背景
アルツハイマー病 (AD) の生物学的サブタイプの分野は注目を増してきており、プレシジョンメディシンや将来的な臨床試験を強力に後押しする一因となりうると想像されている。神経病理と神経画像研究は、一貫して神経原線維変化 (neurofibrillary tangle, NFT) 病理の分布と脳萎縮のパターンに基づいた3つのサブタイプを同定してきた: hippocampal sparing, limbic predominant, typical AD (図1a)。4つ目のサブタイプは minimal atrophy AD として知られ、構造的画像研究でも同定されており、tau PETにおいて minimal tau AD subtype と記述されることを我々が最近報告している。
重要ながら未だ解決されていない疑問として、hippocampal sparing subtype が limbic predominant および typical AD subtype とは異なる神経病理学的経路をたどるのかという点がある。AD の hippocampal sparing subtype は、連合野の萎縮が完全に海馬をスペアして起こることから、MRI研究ではもっともらしいと考えられている。しかし、NFTの蓄積が海馬を完全にスペアしつつ連合皮質に蓄積するということは、Braak and Braak によるNFT変化の広く用いられているモデルと合致しないことから、神経病理研究では疑問が呈されている。このモデルでは、海馬のNFTが連合皮質に先んじて蓄積するとされている。より具体的には、Braak and Braak はNFTの蓄積が典型的には transentorhinal cortex に始まる (さらにentorhinal cortex、海馬CA1、前脳基底部、視床前背側核に少数のNFTが孤立性に認められることもある) と提唱した (Braak stage I)。Stage II では少量のNFTが海馬 (CA1) に蓄積する。Stage IIIでは entorhinal cortex、subiculum、海馬のその他の領域 (CA2-4)、扁桃体に蓄積がみられる。Stage IVになると、被殻や側坐核などの皮質下灰白質構造に蓄積が始まる。一部のNFTはstage IIIおよびIVの間に等皮質に到達するが、連合皮質に高度の蓄積がみられるのはstage Vになってからであり、stage VIになると一次感覚野も巻き込まれる。これらのステージは、Braak and Braak のモデルではtransentorhinal (I-II)、limbic (III-IV)、isocortical (V-VI) stages とまとめられる (図1b)。したがって、hippocampal sparing ADの厳密な定義は、NFTが海馬を巻き込まずに等皮質に到達することを暗示する。
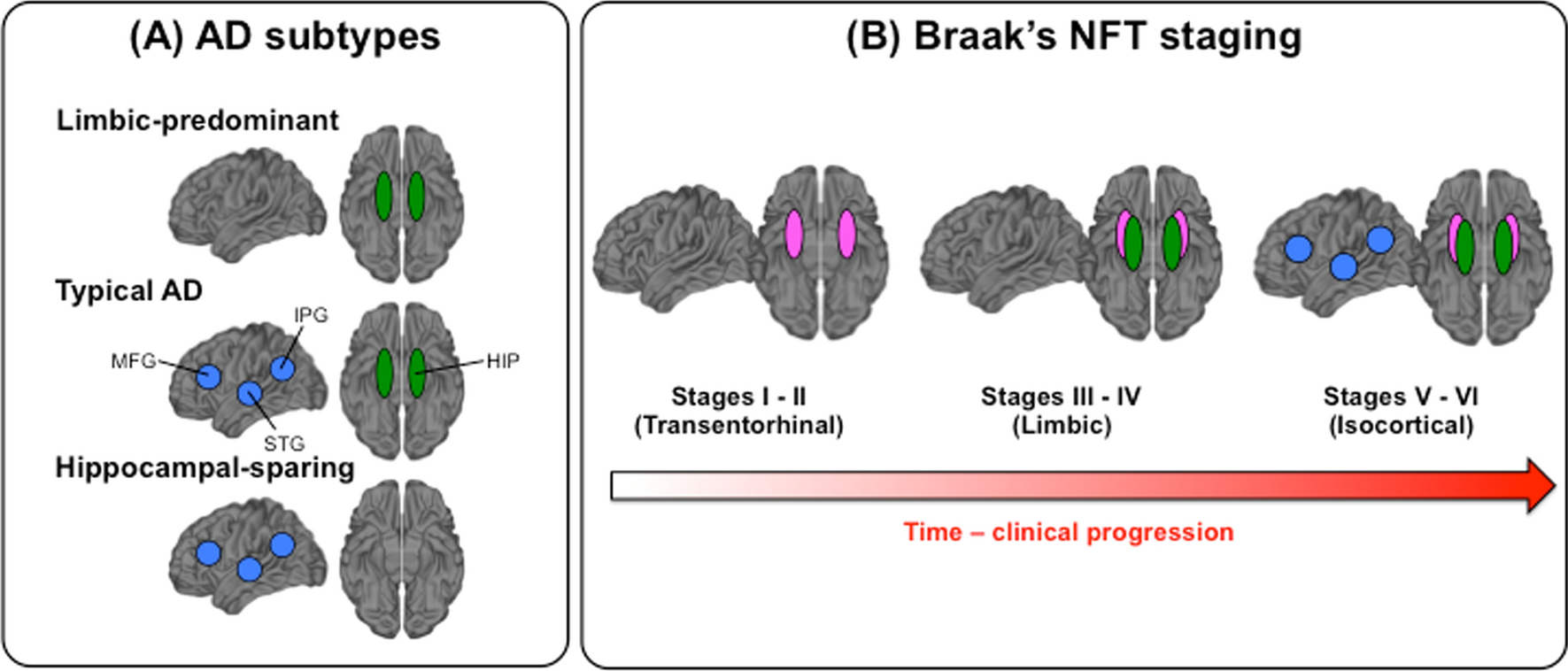
図1. ADサブタイプとBraak NFT statingの模式図: (A) Murrayらによって記述された、サブタイプごとの海馬および連合皮質へのNFTの蓄積パターン。図では、tau NFTが緑色の楕円 (海馬, HIP) および 青色の円 (連合皮質, MFG-STG-IPG) で表現されている。(B) Braak and Braakによるtau NFTの広がりを、stage IからVIまでの時系列として描いた。緑色が海馬、青色が連合皮質、ピンク色が移行嗅内野 (transentorhinal cortex) である。
Hippocampal sparing AD の報告は、2011年に報告された889例の神経病理学的診断のついたADのシリーズが最初であった。全症例がBraak stage > IVであり、NFTが海馬と連合皮質 (図1a, bのようにMFG, STG, IPGとして定義される) の両方に存在していた。同研究では、hippocampal sparing AD は、連合皮質のNFT数が群平均より多く、かつ海馬のNFT数が群平均より低いもので、さらに極端な表現型であることを保証するために海馬 : 皮質のNFT比が25th percentileよりも少ないものとして定義された (Murray's algorithmと呼ばれるもの)。この2011年の文献では、海馬が温存されているのに対し、皮質の関与が大きいことが表現型を定義している。
「比較的スペアされている」ということが強調されていることを考えると、我々の今回の研究の目標は、AD患者が完全に海馬をスペアしつつ連合皮質にNFTを有することがありうるのかを調査し、tau病理の開始地点と到達地点に基づく3つの可能性のある神経病理学的経路について評価することである。この3つの経路 (図2a) とはすなわち以下の通りである: (i) NFT蓄積がBraak and Braakによって定義された定型的順序、すなわち海馬への蓄積が連合皮質への蓄積に常に先行する経路に従って進行する。この場合、hippocampal sparing AD は Braak stage VおよびVI においてのみ生じ、単に連合皮質のNFT数が優位となる症例を反映している (我々はこれを"cortical predominance" hypothesis と呼ぶ; 図2b)。(ii) 連合皮質へのNFT蓄積が海馬への蓄積に先行し、これはBraak stage IIの前のどの段階でも起こりうるが、最終的にはBraak stage V/VIへと収束する (我々はこれを"cortical precedence" hypothesis と呼ぶ; 図2c)。(iii) NFT蓄積が完全に海馬をスペアして連合皮質に生じ、疾患進行段階を経て死に至るまで海馬がスペアされる (我々はこれを"distinct cortical" hypothesis と呼ぶ; 図2d)。この中で、"distinct cortical" hypothesisのみが、hippocampal sparing ADの厳密な定義に当てはまる。対照的に、"cortical predominance" および "cortical precedence" hypotheses はNFTが海馬に存在することを暗示している。我々の研究の目標を達成するために、我々はシステマティックレビューを行い、さらに新規の考察を行うためにオリジナルデータも提示する。
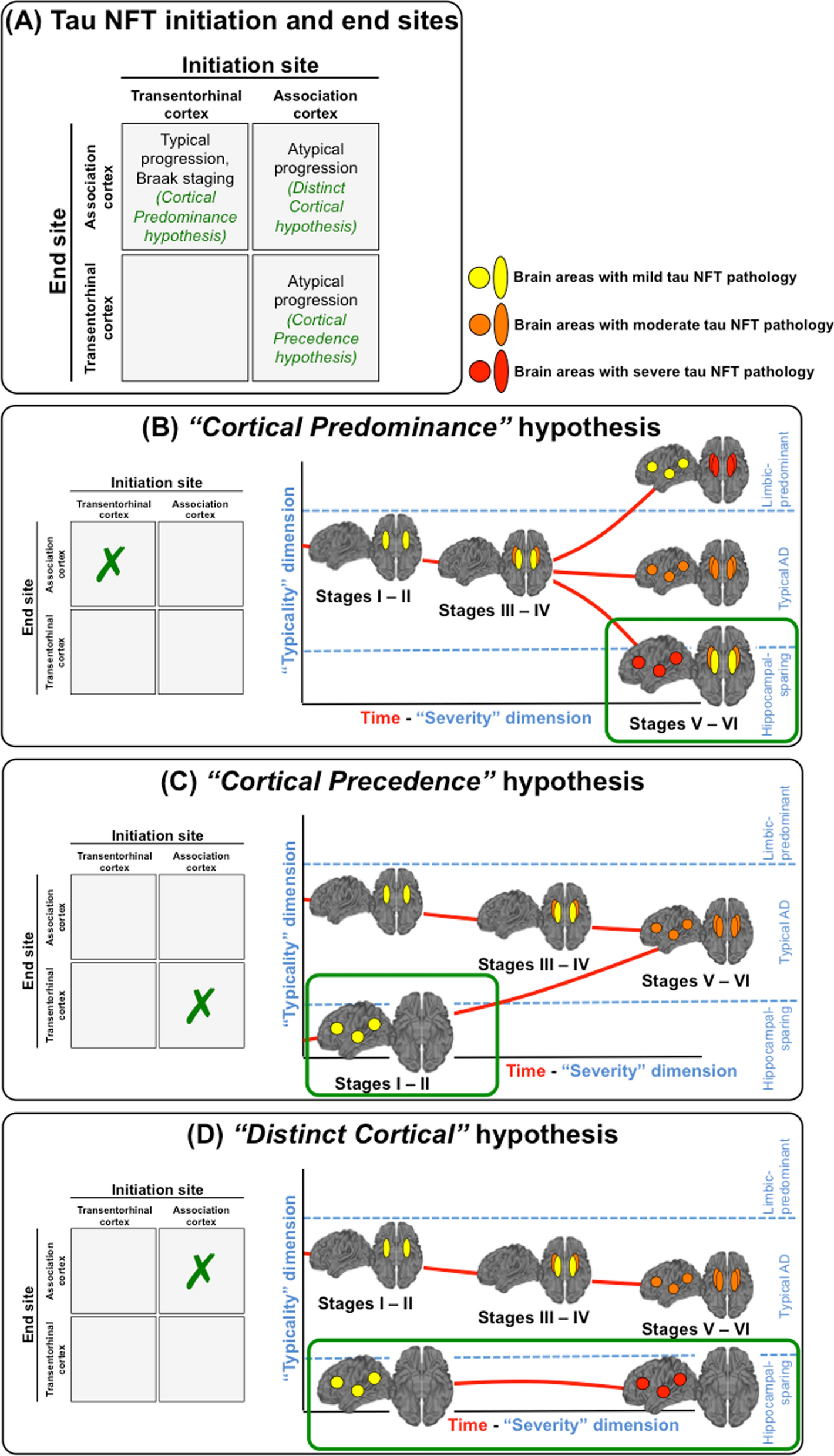
図2. tau病理の異なる開始および終止地点に基づいたhippocampal ADの3つのサブタイプ: (A) tau病理の開始および終止視点に基づき、我々は3つの可能性のあるシナリオを考案した。(B) NFT蓄積がBraak and Braakによって定義された定型的順序、すなわち海馬への蓄積が連合皮質への蓄積に常に先行する経路に従って進行する。この場合、hippocampal sparing AD は Braak stage VおよびVI においてのみ生じ、単に連合皮質のNFT数が優位となる症例を反映している。黄色は軽度、オレンジ色は中等度、赤色は重度のtau病理を反映している。パネルbの色は、hippocampal sparing subtypeでtau病理が皮質において海馬よりも高度の病理をとるという仮説的例示を行っている。しかし、他の病理パターンもありうる。たとえば、典型的ADは皮質と海馬の均等な程度の病理によって定義されており、病理の程度は軽度、中等度、重度のいずれかになるはずである。(C) 連合皮質のNFT蓄積がstage II以前に起き海馬に先行するが、どのようなサブタイプも最終的にBraak stage V/Viに収束する。(D) 連合皮質のNFT蓄積が、疾患経過全体にかけて海馬を完全にスペアする。この中で、"cortical predominance"および"cortical precedence"は海馬におけるtau NFTの存在を暗示することから、"distinct cortical" hypothesisのみが厳密な hippocampal sparing subtype の存在を支持するものである。パネルB, C, Dは hippocampal sparing ADサブタイプの例を示しているだけであり、色使いは単なる例示である。
2. 方法
システマティックレビューなので割愛。
3. 結果
3-1. システマティックレビュー
我々の検索の結果、1,804件のレコードが特定された。重複を削除し、タイトル、アブストラクト、全文でスクリーニングした結果、48件が選択された (図3、青枠)。そのうち30件は、Additional file 1: Table S4に記載されている理由により除外した。その結果、質的統合とオリジナル分析の対象となる研究は合計18件となった (図3、オレンジ色の楕円)。表2 (略) にこれらの研究の主な特徴を示す。選択された研究はすべて、CASPチェックリストに従って適切な方法論的クオリティを有していた。
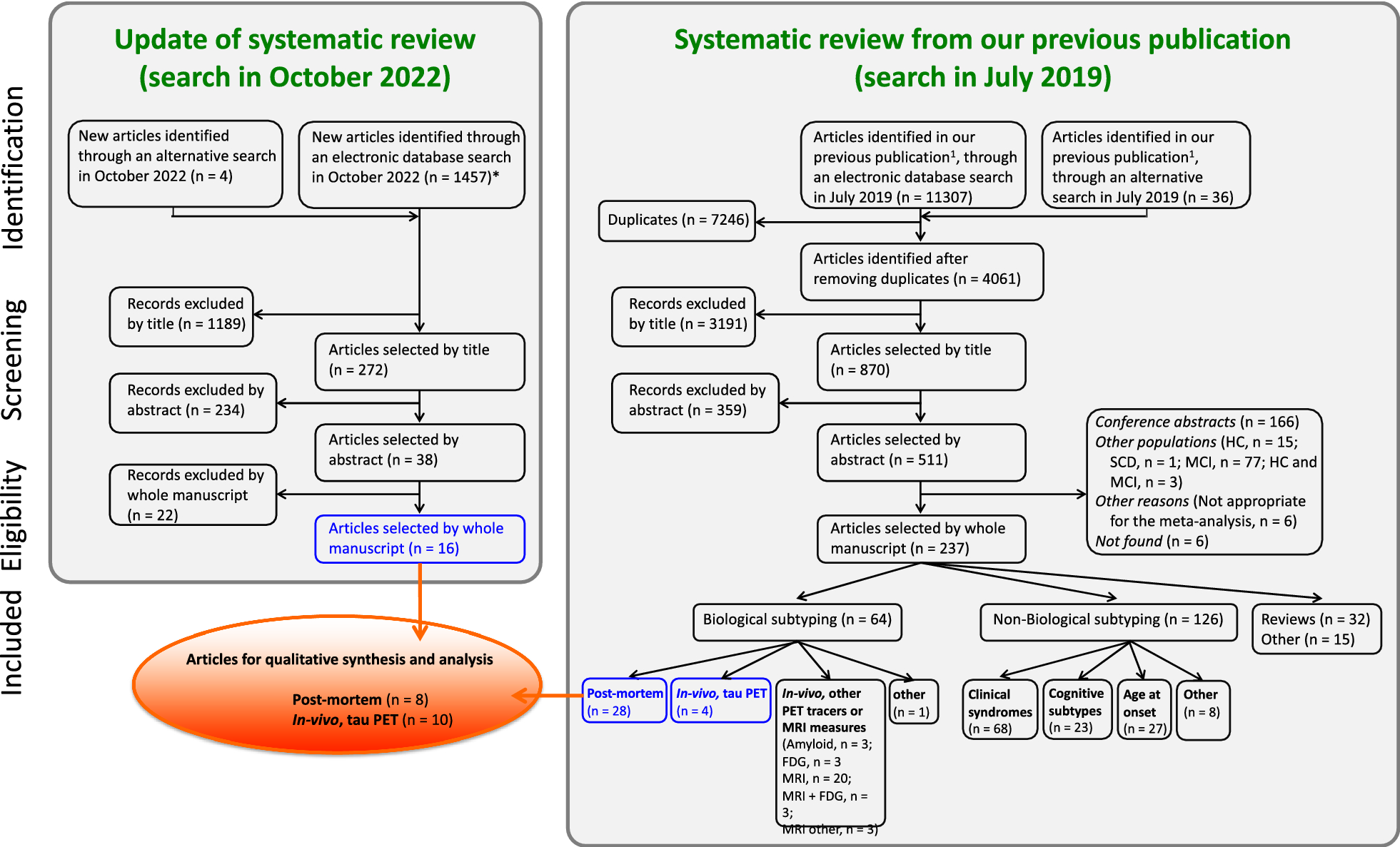
図3. 研究選択のフローチャート: 2019年7月 (右図、n=11,343件ヒット) の検索を2022年10月 (左図、n=1461件) に行った新たな検索で更新することで、12,804件のレコードを特定した。重複を除去し、タイトル、アブストラクト、全文でスクリーニングした結果、48件のレコードが選択された (青枠)。そのうち、Additional file 1: Table S4に記載されている理由により、さらに30件の記録を除外した。その結果、質的統合とオリジナル分析の対象となる研究は合計18件となった (オレンジ色の楕円)。*2022年10月の検索では、2019年7月と同じ医学主題見出し (MeSH) およびフリーテキスト用語を使用したが、実際の検索戦略中に重複は自動的に削除された。
以下に、われわれの主要な疑問、すなわち「AD症例で、海馬 (またはentorhinal cortex) を完全にスペアしながら連合皮質にNFTを認めることがあるのか?」という疑問に関するデータを提供した研究の説明文を掲載する。
Murrayらの研究では、症例の11% (97/889) が hippocampal sparing AD subtype に属していた。すべての hippocampal sparing AD はBraak stage > IVであり、海馬への影響を示唆していた。したがって、連合皮質にNFTを認めたAD症例のうち、海馬のNFTを完全に免れた症例はなかった。最近の研究では、Braak stage > IVの1,361例のAD症例からなる、より大規模で最新のコホートにこれらの症例が含まれている。報告された hippocampal sparing AD 症例の頻度は13% (175/1361) であった。これら2つのコホートの間には部分的な重複があるため、表3の分析では、Murrayらの精力的かつ重要な研究を考慮することとした。


表3. 先行研究および我々のオリジナルデータにおける hippocampal-sparing AD の頻度:
a: Braak stagingはタウPETデータに基づいている。
b: Murrayのサブタイプ分類アルゴリズムは、Murrayらの文献で説明されている。簡単に説明すると、海馬と皮質のNFT数の比を標本分布の25%と75%で分割した。第一段階として、比率が25%未満の人はhippocampal sparing AD、75%以上の人はlimbic predominant AD、それ以外はtypical ADとした。第二段階として、海馬と大脳皮質のNFT数の中央値に基づいて個人を再分類した。Murrayのサブタイプ分類アルゴリズムで考慮された脳領域は、海馬 (CA1とsubiculum)、上側頭皮質、中前頭皮質、下頭頂皮質である。
c: Schwarzらは、tauの病期分類に3つの分類法を用いた。最初の分類法はSchwarzらによる初期の分類法と同じで、Braak分類法をできるだけ模倣したものである。第二の方法は、第一の方法を簡略化したもので、ROIをより少数かつ大きくするために、内側、外側、上側頭葉と一次視覚野に設定したものである。第3のスキームは最初の2つのスキームよりもさらに単純化され、側頭葉、前頭葉、頭頂葉、後頭葉のROIを用いた。パーセンテージはアルゴリズム順に報告されている (第1、第2、第3アルゴリズム)。
d: Charilらのサブタイピングアルゴリズムは、Murrayらのアルゴリズムと同じであるが、アルゴリズムで考慮する脳領域に関して若干の違いがあり、海馬のCA1とsubiculumを、海馬の最前方位置またはentorhinal cortexに置き換えている。上側頭皮質、中前頭皮質、下頭頂皮質については、Murrayらと同じ。
e: Byunらに記載されたオリジナルのアルゴリズムに基づき、ADNIのアミロイド陰性健常対照の規範群に基づく重回帰を用いて、局所タウPET取り込み測定値を年齢で調整した。正常群を用いて、海馬/entorhinal cortex、前頭、側頭、頭頂領域のZスコアを算出し、Zスコア>1.0の場合に異常と分類した。Byunのアルゴリズムで考慮された脳領域は、Murrayらと同じであるが、海馬のCA1領域とsubiculumを海馬またはentorhinal cortexに置き換えるというわずかな違いがある。上側頭皮質、中前頭皮質、下頭頂皮質は、Murrayら[7]と同じである。
f: Risacherらのサブタイピングアルゴリズムは、Murrayらと同じである。ただし、アルゴリズムで考慮する脳領域に関して若干の違いがあり、海馬のCA1領域とsubiculumを海馬またはentorhinal cortexに代え、皮質領域を拡張して中前頭皮質、下前頭皮質、上側頭皮質、下頭頂皮質、上頭頂皮質、縁上回皮質とした。
g: 海馬の代わりにentorhinal cortexに基づく。カットポイントやサブタイプ分類方法とは無関係に、すべてのタウPETデータをプールして、海馬を完全にスペアしながら連合皮質にNFTを認めた症例のおおよその割合を推定した。そのため、表の「NFT数またはタウPET取り込みが海馬を完全にスペアした人の割合」セクションのタウPET研究の各セルは、独立した研究として扱われた。海馬を完全にスペアした症例の合計 (n = 372) を計算し、研究に含まれる症例の総数 (N = 5583) で割った。その結果、割合は8%となった。
Whitwellらは、神経病理学的にADと診断された177例の独立したサンプルにMurrayのアルゴリズムを適用した。Hippocampal-sparing AD の割合は11% (19/177) であった。Murrayらと同様に、hippocampal-sparing AD はすべてBraak stage > IVであり、海馬への影響を示唆していた。すなわち、海馬のNFTが完全にスペアされた症例はなかった。驚くべきことに、神経病理学的に海馬をスペアしていると定義されたAD症例は、MRIデータ (群レベル) によって評価された萎縮の観点で、海馬が完全にスペアされていた。このことは、海馬のNFT数の割合が連合皮質よりも低いAD症例は、健常対照と比較した場合、MRI上では海馬容積の減少 (または entorhinal cortex の菲薄化) を示さないことを示している。最近の別の研究は、同じコホートを用いたが、Braak stage > IV-VI (N=36) のnon-amnestic AD症例にのみ焦点を当てた。この中では、hippocampal-sparing AD症例の頻度は31% (11/36) であり、atypical ADにおいてこのサブタイプの頻度が高いことを示している。これら2つのコホートは重複しているため、表3の分析ではWhitwellらのより大規模な研究を考慮している。
PetersenらもMurrayのサブタイピングアルゴリズムを適応し、神経病理学的診断のついた74症例のADについて検討した。全症例がBraak stage > IVであった。サブタイプ分類のための群平均は、閾値に影響を与えうるような共存病理が存在しない純粋な74人のAD症例から導かれた。臨床的には、typical ADから様々なatypical/non-amnestic syndromesまでを含んでいた。Hippocampal sparing ADの割合は7% (5/74) であった。連合皮質にNFTを有した症例で、海馬のNFTを完全にスペアしていた症例はいなかった。
UretskyらはMurraのサブタイピングアルゴリズムと類似した方法を用いて、神経病理学的に診断のついた292例のADに対して検討を行った。全症例がBraak stage > IVであったが、臨床診断はAD dementia、prodromal AD、preclinical AD、mixed AD dementia、non-AD dementiaなどさまざまであった。Hippocampal sparing ADの割合は8% (22/292) であった。連合皮質にNFTを有した症例で、海馬のNFTを完全にスペアしていた症例はいなかった。
Smirnovらも、Murraのサブタイピングアルゴリズムと類似した方法を用いて、神経病理学的に診断のついた121例のADに対して検討を行った。全症例がBraak stage > IVであったが、臨床診断はAD dementia、prodromal AD、non-AD dementiaなどさまざまであった。Hippocampal sparing AD の割合は19% (23/121) であった。連合皮質にNFTを有した症例で、海馬のNFTを完全にスペアしていた症例はいなかった。
Corderらの検討では、連合皮質にNFTを有していた全症例がCA1およびsubiculumにNFT蓄積を有していた。したがって、報告されたデータと同様に、連合皮質にNFTを有した症例で、海馬のNFTを完全にスペアしていた症例はいなかったということになる。この解析は249例に基づいたものであった。159例が神経病理学的にADと診断されており、Braak stageは IからVI まで様々であった。
これらの8つの神経病理学的研究は、"cortical predominance" および "cortical precedence" hypotheses (図2b, c) を支持するものであった。しかしながら、Corderらを除き、これらの研究は "distinct cortical" hypothesis を実際に検証しているものではない。なぜならば、ほかの研究はすべて Braak stage IV or > IV の症例のみを対象としていたからである。
Schwarzらは、tau PET tracerであるflortaucipirを用いて、in vivoでNFTを評価した。彼らの研究では、アミロイド陽性のprodromal ADまたはAD dementia患者の5% (4/75) が、海馬を完全にスペアして連合皮質にflortaucipirの取り込みを認めた (海馬のflortaucipir取り込みは正常)。しかし、彼らがテストした皮質領域の中で、これらの4人の参加者はentorhinal cortexで異常なflortaucipirの取り込みを示していた。
後の発表で、SchwarzらはADNIコホートでtau PET tracerであるflortaucipirを使用し、46人の認知機能正常者 (19人がアミロイド陽性)、42人の軽度認知障害 (MCI) 者 (24人がアミロイド陽性)、10人のAD-dementia患者 (9人がアミロイド陽性) を対象とした研究を行った。著者らはtauの病期分類について3つの分類法を検証した。Braak stage分類をできるだけ忠実に模倣した最初の分類法では、14% (14/98人) の参加者が海馬を完全にスペアしていた一方、連合皮質でflortaucipirの異常取り込みを示した。このうち3人にentorhinal cortexでのflortaucipir異常取り込みがみられた。2番目のスキームは、最初のスキームを簡略化したもので、ROIを大きくして数を少なくした。参加者の7% (7/98) が、内側側頭葉を完全にスペアしながら、連合皮質にflortaucipirの異常取り込みを示した。3番目の方法は、最初の2つの方法よりもさらに単純で、lobar ROIを使用したもので、側頭葉を完全に温存しながら側頭葉以外にflotaucipirの異常取り込みがあったのは、参加者のわずか1% (1/98) であった。しかし、アミロイドの状態別に層別化したデータが報告されていないため、これらの症例の一部がアミロイド陰性である可能性は否定できない。
Whitwellらは、アミロイド陽性のAD dementia患者62人を対象に、entorhinal cortexと17の新皮質領域を含むROIにおけるfortaucipir取り込みのクラスタリング解析を行った。著者らの報告によると、参加者の34% (21/62人) は、Hippocampal-sparing ADの定義と一致して、entorhinal cortexおよび新皮質のflortaucipir取り込みが低値および高値に分類された。
Charilらは、Murrayのサブタイピングアルゴリズムを、flortaucipir tracerを用いたtau PETデータに適応した。すべての被験者はアミロイドβ陽性であった。23人がprodromal AD、22人がAD dementiaであった。著者らは、13% (6/45) が hippocampal sparing AD と分類されたと報告した。しかし、Murrayらの報告と同様に、すべてのhippocampal paring AD症例がtau PETでBraak stages > IVに分類され、海馬への影響が示唆された。よって、海馬が完全にスペアされた症例は存在しなかった。
YoungらはMurrayらのサブタイピングアルゴリズムと類似した方法を用いて、flortaucipir tracerを用いたtau PETデータについて検討した。すべての被験者はアミロイドβ陽性であり、認知機能は保たれていた。著者らは9% (36/392) の被験者が、凡そhippocampal sparing ADとして合致するような、釣り合いのとれない皮質tau蓄積パターンを持っていたと報告した。
Toledoらは、tau PET tracerであるflortaucipirを用いたデータドリブン手法を用いた。参加者はすべてアミロイドβ陽性で、AD dementia、prodromal AD、認知機能が低下していない症例を含んでいた。彼らのデータドリブン手法では、tau PETの取り込みの増加の勾配内にクラスターを同定した (cluster 1: n = 181; cluster 2: n = 75; cluster 3: n = 16; cluster 4: n = 10)。最も大きなクラスターであるcluster 1は感度分析でサブクラスター化され、hippocampal sparing ADと一致するサブタイプの存在を示した。しかし、このサブタイプの頻度は報告されていない。
Palleisらは、異なるtau PET tracerである18F-PI-2620を使用した。著者らは45名のCBS患者を対象とし、そのうち10名はバイオマーカーに基づいたAD病理を有していた。著者らによって報告されたデータを視覚的に検証すると、参加者の60% (6/10) が皮質領域でtau PET陽性であり、内側側頭葉でtau PET陰性であった。
Rullmannらもtau PET tracer 18F-PI-2620を使用した。著者らはアミロイドβ陽性のAD demenia患者38人を評価した。著者らは、参加者の18% (7/38) がhippocampal-sparing ADサブタイプに分類されたと報告している。著者らは、Schwarzらと同じ方法を用いたので、これらの参加者は、海馬を完全にスペアしながら、連合皮質で18F-PI-2620の取り込みを示した (海馬での18F-PI-2620の取り込みは正常)。しかし、著者らは18F-PI-2620取り込みがentorhinal cortexもスペアしていたかどうかについては報告していない。
Krishnadasらは、3つ目の異なるtau PET tracerである18F-MK-6240を使用した。参加者全員がアミロイドβ陽性で、67人がprodromal AD、84人がAD dementiaであった。著者らは、参加者の18% (27/151人) がhippocampal sparing ADに分類されたと報告している。
以上から、tau PET研究から得られた結果は、"distinct cortical" hypothesis (図2d) を支持する予備データとなりうる。この "distinct cortical" hypothesisをさらに検証するために、我々はWhitwellら、Charilら、Youngらの利用可能なデータを再解析し、ADNIコホートの中で海馬またはentorhinal cortexのtau PET取り込みが正常なhippocampal sparing ADを同定した。
3-2. オリジナルデータ
表3は、Whitwellら、Charilら、Youngらの報告データを我々が再解析したものである。
Whitwellらのデータでは、hippocampal sparing AD患者21名のうち2名が、'accuracy-based cut point' に基づくentorhinla cortexを完全にスペアしたパターンを有していた (コホート全体の3%、2/62名)。また、'+1SD cut point' と '10% cut point' では、hippocampal sparing ADの21人全員が、entorhinal cortexを完全にスペアしたflortaucipirの取り込みパターンを有していた (コホート全体の34%、21/62人)。'Schöll cut point' と 'Maass cut point' の割合は、それぞれ5%と2%であった (表3)。
Charilらのデータでは、hippocampal sparing AD患者6人のうち4人が、'accuracy-based cut point' に基づく海馬を完全にスペアしたfortaucipir取り込みパターンを有していた (コホート全体の9%、4/45)。また、'+1SD cut point' と '10% cut point' では、hippocampal sparing AD被験者全員が、海馬を完全にスペアしたflortaucipir取り込みパターンを有していた (コホート全体の13%、6/45人)。'Schöll cut point' と 'Maass cut point' の割合は、それぞれ11%と2%であった (表3)。
Youngらの12名では、hippocampal sparing ADの36名のうち23名が、'accuracy-based cut point'によって、内側側頭葉を完全に温存したfortaucipir取り込みパターンを有していた (全コホートの6%、23/392名)。また、'+1SD cut point' と '10% cut point' では、hippocampal sparing AD被験者全員が、内側側頭葉を完全にスペアしたflortaucipir取り込みパターンを有していた (コホート全体の9%、36/392人)。'Schöll cut point' と 'Maass cut point' の割合は、それぞれ7%と1%であった (表3)。
最後に、ADNIコホートを用いて新しいデータを作成した。Mohantyらの最近の研究では、ADNIコホートのtau PETデータ (flortaucipir) に3つのサブタイピングアルゴリズムを適用した。Byunらに基づくアルゴリズムは、アミロイド陽性のprodromal ADまたはAD dementia参加者の21% (18/84) がhippocampal sparing ADサブタイプに属することを明らかにした。もともと'+1SD cut point' に基づいたこのアルゴリズムによると、18人のhippocampal sparing AD全員が、海馬を完全にスペアしたfortaucipir取り込みパターンを有していた。代替カットポイントのパーセンテージを表3に示すが、0%から21%の範囲である。CharilらとRisacherらのアルゴリズムをADNIコホートで再現したところ、アミロイド陽性のprodromal ADまたはAD dementia患者のうち、それぞれ10% (8/84) と11% (9/84) がhippocampal ADサブタイプに属することがわかった。しかし、CharilらとRisacherらのアルゴリズムは、hippocampal sparing AD参加者が海馬のflortaucipir取り込み値に異常がある可能性を完全に否定するものではない。その理由は、これら2つのアルゴリズムでは、海馬のflortaucipir取り込みに比べて連合野のflortaucipir取り込みが最も高い25%の症例をhippocampal sparing ADと定義しているからである。そこで、CharilらとRisacherらのアルゴリズムを用い、表1に記載されたカットポイントを用いて、flortaucipir取り込みの異常レベルを決定した。その結果、'accuracy-based cut point' を適用した場合、海馬を完全にスペアしてflortaucipirを取り込むパターンを持つ参加者はいなかった (0%、0/84)。CharilらとRisacherらのアルゴリズムでは、'+1SD cut point' と '+10% cut point'を適用した場合、被験者の6% (5/84) と7% (6/84) が、それぞれ海馬を完全にスペアするflortaucipir取り込みパターンを有していた。'Schöll cut point' と 'Maass cut point' の割合は0%であった (表3)。この段落の結果はすべて、連合野と海馬に基づくサブタイピングによるものである。対照として、連合野と嗅内皮質に基づいてサブタイピングを行ったところ、非常に類似した結果が観察された。
まとめると、サブタイピングアルゴリズムやコホートとは無関係に、tau PETによって、複数のcut pointが一貫して海馬 (またはentorhinal cortex) が完全にスペアされつつ連合皮質にNFTを有する患者を同定した。しかしながら、よりcut pointが保守的となるほど ('accuracy-based cut point', 'Schöll cut point', 'Maass cut point')、hippocampal sparing ADの頻度は低下し、一部の解析では同定することができないこともあった。
4. 考察
今回の研究で我々は、連合皮質にNFTを持つが海馬 (またはentorhinal cortex) が完全にスペアされたAD症例を、神経病理およびin-vivo tau PETを用いて同定できるのか、という疑問について扱った。我々の発見から、これらの症例は生前に同定可能であることが示唆されたが、これはhippocampal sparing ADの定義の仕方に依存し、かつtau病理を評価するためのデータモダリティおよびカットポイントに依存した。この発見は、将来的な研究において、ADの生物学的サブタイプの操作的な分類方法に関するコンセンサスを得ることの重要性を反映している。
いくつかのin-vivo研究は、tauが海馬を完全にスペアしつつ連合皮質に蓄積することの支持的エビデンスを提供している。しかし、これらの症例はADにおいて極めて珍しく、tau PET imagingにおいてのみ検出可能なものであった。今回の研究でレビューした8つの神経病理学的研究では、我々は海馬を完全にスペアしつつ連合皮質にNFTを有する個々の症例を同定することはできなかった。しかし、これらの研究のうち6つはBraak stage > IVを対象としており、もう1つはBraak stage > IIIを対象としていたことから、Braak IIIから病変が現れ始めると考えられている辺縁系領域である海馬の関与がすでに暗示されていた。特記すべきこととして、hippocampal sparing ADを操作的に定義した最初の神経病理学的アルゴリズムを作成する際には、NFT数をthioflavin-S蛍光染色で確かめる必要があった。リン酸化tauのマーカー (e.g. AT8) は、tangleの成熟の初期の側面を認識することができ、神経細胞死に完全に対応しないtau病理を明らかにするものである。研究デザインとは解離して、神経病理学的研究では、海馬を完全にスペアしつつ連合皮質にNFT蓄積を有するAD症例を同定する能力が低かった可能性がある。この1つの理由として、神経病理学的研究は疾患の進行段階にある患者を組み入れる傾向があるからである。Braak and Del Trediciは、2366例の非選択的剖検例のコホートの中で、80歳以上の患者のほぼ全例が海馬にNFTを有していたと記述した。海馬におけるNFTの頻度は、30から79歳の間では30から85%とされた。したがって、海馬をスペアした症例を検出できる確率自体が極めて低く、もしあったとしても、それは60歳以下の患者を対象としたときなどであろう。実のところ、Murrayらによるhippocampal sparing ADの症例の多くは、発症年齢が60歳以下であった。
一方で、PETイメージングではin vivoでtau蓄積を若年および疾患早期段階において検出できることから、hippocampal sparing AD症例を同定できる可能性が高まる。これは、我々の今回の研究からも示唆されたことである。我々のtau PET解析は、すべてのデータをプールすると、372/5583症例 (8%) が海馬を完全にスペアしつつ連合皮質にtau PETの取り込み上昇を認めたことを示した。重要な疑問は、我々の症例が "cortical precedence" hypothesis、すなわちNFT蓄積が連合皮質に始まり、疾患の進行とともに海馬に蓄積し始めるという経過にフィットするのか、それとも "distinct cortical" hypothesis、すなわちNFT蓄積が連合皮質に始まり、海馬には疾患経過全体を通して蓄積がみられないという経過にフィットするのか、ということである。残念ながら、現在のところこの疑問に答えることができるデータは存在しない。なぜならば、これを明らかにするためには、tau negative -> tau positive -> death までの経過をtau PETで追う必要があるからである。神経病理学的研究に関しては、Braak 0からVI までを含んだ患者データセットに対するサブタイピング研究が必要である。
Hippocampal sparing ADを検出するにおいて、tau PET研究における主要な懸念点は、技術的課題が除外された上でも、用いられたcut pointに依存するということである。実際、この問題はtau PET研究に限ったことではなく、医学および科学においてあらゆる手法、モダリティ、集団で異常を検出しようとしたときに出くわす一般的な問題である。これを回避するために、我々は5つの異なるcut pointを用いた。我々は、近年用いられつつある 'accuracy-based cut point' を用いた (flortaucipirに対しては1.33)。しかし、より緩いまたは保守的なcut pointも存在している。さらに、1.33というcut pointはmeta-ROI領域に対するものであり、海馬やentorhinal cortexに対するflortaucipir取り込みのcut pointは未だ合意の得られたものがない。したがって我々は、'+1SD cut point' および '10% cut point' や ''Schöll cut point' および 'Maass cut point' を用いた検討も行った。
Tau PETで明らかになったように、海馬やentorhinal cortexを完全にスペアしながら連合皮質にNFTを認める被験者は、サブタイピングアルゴリズムやコホートとは無関係に、いくつかのカットポイントで同定されることがわかった。実際、海馬をスペアした被験者の何人かは、どのカットポイントからも離れて海馬/entorhinal cortexで正常なfortaucipir取り込み値を示し、tau PETがこのような症例を同定できることを強調していた。しかし、より保守的なカットポイントでは、少なくとも我々の解析に用いたADNIデータでは、これらの症例は検出されなかった。したがって、本研究は、in vivoでBraak病期分類を行うことや、またADサブタイプを同定することなどの科学的な疑問に対して、特定の脳領域に対するcut pointを開発し、それに合意することの重要性を示している。さらに、cut pointは、ADNIのような厳格な選択基準を持つ研究コホートだけでなく、さまざまな大規模非選択コホートでもテストされ、検証されるべきである。
海馬/entorhinal cortexを完全にスペアしたhippocampal sparing caseの存在は、DLBのような疾患におけるNFTの異なる波及経路を示唆する最近のデータによっても支持される。DLBにおけるflortaucipir取り込みは、後方皮質領域を主に含んでおり、海馬/entorhinal領域をスペアしていた。non-AD tauopathyにおけるflortaucipir取り込みの意味を十分に理解するためにはさらなる研究が必要だが、DLBにおけるこの非典型的なflortaucipir取り込みパターンは、DLBにおける特徴的な頭頂および後頭皮質を含むFDG PET低代謝パターン、白質高信号域の位置、脳血流低下領域と完全にマッチしている。興味深いことに、ヨーロッパの15個の施設から抽出した333人のDLB被験者に対して我々のADサブタイピングアルゴリズムを適応したところ、hippocampal sparingはDLBにおけるもっとも多い萎縮パターンであったことが示された。ほかのデータも考慮すると、レビー小体病理の共存はADのhippocampal sparing subtypeと関連している可能性が示唆される。しかし、他のコホートでは、レビー小体病理がlimbic predominant および typical ADにおいて高頻度であったことが報告されている。このため、レビー小体病理とADサブタイプの関係性は、今後のさらなる検証を必要とする。我々は最近、hippocampal sparing ADではコリン作動性前脳基底部の容積低下はより緩徐に進行し、コリン作動性治療に対する反応がよいことを報告した。海馬の萎縮が少ないADおよびDLB患者は、コリンエステラーゼ阻害剤に対する反応性が高い。Hippocampal sparing ADにおけるマイネルト基底核のNFT数が低いという神経病理学的観察を支持するように、コリン作動性入力に反応する海馬が保たれていることが、DLBとhippocampal sparing ADにおけるコリン作動性治療に対する良好な反応の説明となる可能性が示唆された。Hippocampal sparing ADに共通する脳萎縮のパターンか、レビー小体病理の増加か、あるいはその両方がこの所見の理由であるかは、明らかにする必要がある。連合野のflortaucipir取り込み値に異常があるが、海馬/entorhinal cortexは完全にスペアされている参加者の一部は、レビー小体病態を併存するAD患者というよりも、ADと診断されたレビー小体病患者である可能性がある。この可能性を支持する所見として、レビー小体病を合併したAD症例は海馬にNFTがある可能性が高いことが挙げられる。
MRI研究では一貫してhippocampal sparing ADが同定されている。しかし、MRI研究では脳の局所的萎縮のばらつきが評価されている。MRIは神経病理学的に定義されたADのサブタイプを確実に追跡することができるが、NFT以外の神経病理も脳の局所萎縮のばらつきに寄与している。したがって、神経病理学的確証のないMRI研究でhippocampal sparing ADと分類された被験者の一部は、連合皮質にNFTを認めず、むしろ他の神経病理を有している可能性がある。同様に、MRI検査で典型的なADと分類された参加者の一部は、海馬硬化症、TDP-43、脳血管障害などの病態に起因する海馬萎縮を伴い、連合皮質のみにNFTを有する可能性がある。この考えは、Mohantyらによる最近の論文でも支持されている。さらに、NFTの蓄積とその後の脳萎縮との間の時間的ずれは、MRI研究におけるhippocampal sparing ADの交絡因子である可能性がある。言い換えれば、神経病理学的確証のないMRI研究でhippocampal sparing ADと分類された参加者の一部は、典型的なNFT蓄積パターンを有する可能性がある。たとえば、Ossenkoppeleらは最近、MRIで定義されたhippocampal sparing ADサブタイプでは、連合皮質における顕著なflortaucipir取り込みに加えて、entorhinal cortexにおけるflortaucipir取り込みが上昇していることを示した。また、MRIで定義されたhippocampal sparing ADサブタイプの参加者は、flortaucipirのデータを用いると、typical AD、あるいはlimbic predominant ADに分類できることも示した。神経病理学的経路に関する議論と同様に、MRIデータに縦断的クラスタリングを適用した現在までの唯一の研究では、hippocampal sparingサブタイプは最終的にtypical ADの萎縮パターンを示し、海馬/entorhinal cortexを含むことが示された。これは "cortical precedence" hypothesisを支持するものであるが、個人レベルでの分析により、"distinct cortical" hypothesis に当てはまる症例があるかどうかを確認することができる。
今後の展望としては、第二世代のtau PET tracerを用いた研究の蓄積、tau PETの異常を判定するためのセンチロイドアプローチの導入、マイネルト基底核や青斑核などの皮質下核を含めた現在のサブタイプ分類の根拠の拡張などが挙げられる。ほとんどのtau PETサブタイプ研究ではflortaucipirが用いられているが、18F-PI-2620を用いた最近の研究が2件、18F-MK-6240を用いた研究が1件ある。flortaucipirは後期Braak病期を構成する領域のタウ病態を描出するのに優れているが、初期タウ病期に対する性能はより限定的である。18F-PI-2620や18F-MK-6240のような第2世代のtau PET tracerは、早期tau病理に対してより感度が高いようであり、hippocampal sparing ADの同定に役立つ可能性がある。この考えは今回の解析でも支持されているが、この所見を確認するためには、より多くの第二世代tau PET tracer研究が必要である。複数のtau PET tracerを含むhead-to-headの研究は少ないが、最近の研究では、flortaucipirと第二世代のtau PET tracer (RO-948、MK6240) の集積領域に違いがあることが示されている。今後の展望としては、hippocampal sparing症例や一般的なatypical AD症例における異なるtau PET tracerの性能を理解することである。さらに、カットポイントはやや恣意的である。そのため、5つの補完的なカットポイントを検討した。Amyloid PETと同様に、tau PETの分野でも、単一の標準化された尺度が使用できるように、センチロイドアプローチが現在推進されている。今後の研究では、センチロイドアプローチのサブタイプ分類における潜在的な利点を検証する必要がある。最後に、大脳辺縁系/皮質系脳領域におけるNFTに先行して、青斑核とマイネルト基底核がNFTの最も早い蓄積部位である可能性を示唆するデータがある。ADの生物学的サブタイプ分類の分野では、マイネルト基底核と青斑核はまだサブタイプ分類アルゴリズムに組み込まれていないため、今回の研究では大脳辺縁系/皮質系のNFTに焦点を当てた。
本研究の限界は、Murrayのアルゴリズムによって決定されたhippocampal sparing ADの割合が、そのアルゴリズムにおけるhippocampal sparing ADの定義 (25パーセンタイル) に部分的に影響されていることである。それにもかかわらず、我々の研究によると、Murrayのアルゴリズムで得られたパーセンテージは、他の調査アルゴリズムで得られたパーセンテージの範囲内にあるようである。Hippocampal sparing ADの割合も、tau PETのカットポイントが保守的な場合と緩やかな場合で異なっていた。今後の研究ではtau PETの視覚的評価を用いて、現在のアプローチを補完することも可能であろう。
本研究は、tau PETが、海馬を完全に温存したNFTを有するhippocampal sparing症例を同定できることを示している。神経病理学的にもこのような症例を同定できる可能性は否定できないが、システマティックレビューで同定された8件の神経病理学的研究のうち7件は、定義上海馬にNFTを認めるBraak stage IV以上の症例のみを解析している。今後のサブタイプ分類研究には、Braak stage 0からVI までの症例を含めるべきである。さらに、hippocampal sparing ADにおけるNFTの広がりに関する3つの仮説を紹介した。今後の研究では、アミロイド陽性のAD連続症例における縦断的タウPETデータを用いて、hippocampal sparing ADにおけるNFT蓄積の時間的軌跡をin vivoで調査する必要がある。これによって、hippocampal sparing ADの病因が、海馬が完全にスペアされたまま連合皮質でNFTが始まるのか ("distinct cortical" hypothesis)、あるいはBraakの進行段階で連合皮質と海馬の両方でNFTが観察されるのか("cortical predominance" または "cortical precedence" hypotheses)を解明することができる。VogelらとFranzmeierらによる横断的tau PETデータに基づく最近の研究では、まれではあるが、entorhinal cortexに代わるtau拡散の根源を示す被験者がいることが示された。たとえば、Vogelらのhippocampal sparing ADに類似したサブタイプの一つでは、tauは頭頂部から側頭葉、前頭葉へと急速に進行し、疾患進行全体にわたって内側側頭葉は温存されているようであった。このサブタイプは"distinct cortical" hypothesis に合致するため、NFTが海馬を完全にスペアするhippocampal sparing 症例である可能性がある。
蓄積されたデータを総合すると、大脳辺縁系/大脳皮質のtauの広がりには、おそらく2つの独立した経路があり、バイオマーカーで測定された病態の閾値レベル以下から始まり、海馬/entorhinal cortexまたは連合皮質のいずれかに病態の程度が最小化されることが示唆される。最も一般的な経路は、Braak病期分類に包含されるようなNFTの広がりである。あまり一般的でない代替経路は、海馬や嗅内皮質の関与を伴わずに連合皮質でタウの拡散が始まり、徐々に蓄積していく ("distinct cortical" hypothesis)、あるいは疾患の進行に伴って海馬や嗅内皮質の関与を伴う ("cortical precedence" または "cortical predominance" hypotheses) であろう (図2b-d)。Tau病理はマイネルト基底核でも始まる可能性が示唆されており、また、いくつかの部位で並行して独立して始まる可能性さえある。
読者が、海馬をスペアした症例がそのサブタイプに属するかどうかの確実性と、カットポイントがその分類にどのように影響するかを評価できるように、今後の研究では、個々の症例におけるNFT数またtau PET取り込みレベルを報告することを推奨する。また、今後の神経病理学的研究では、Braak stage 0またはI (海馬にNFTを認めない症例) の連合皮質におけるNFT数を調べることができるだろう。これらの提案はすべて、この分野を前進させ続けるのに役立つであろうし、今回の研究は、研究間で生物学的ADサブタイプの運用方法を調和させることの重要性を示している。
感想
PETも病理も専門ではないので、手法ごとの感度の限界がわからず、そうなんだーという感じの読み方しかできなかった。Hippocampal sparing ADという言い方は病理や画像ありきの言葉ではあって臨床の言葉ではないということが学べたのでよしとする。臨床的にはやっぱり、non-amnestic ADなのかなあ・・・?頭頂葉機能障害から発症するタイプって適切なラベルがない気がする。PCAではないし・・・。とりあえずUP。