β-Amyloid discordance of cerebrospinal fluid and positron emission tomography imaging shows distinct spatial tau patterns.
Jiang, Chenyang, et al.
Brain Communications 4.2 (2022): fcac084.

ADの (Aβの) PETとCSFの解離について、今どれくらい研究されているのかなと思って調べてみたら、10個はいかないくらいの数の論文が出てきました。この論文を選んだのは、Graphical Abstractがあって面白そうだとおもったから...。
1. 背景
細胞外のβアミロイド (Aβ) プラークと細胞内の神経原線維変化はアルツハイマー病の主要な特徴であり、Aβ病理の異常な変化はアルツハイマー病の最初期の検出可能な変化と考えられている。Aβ病理は生体内PETイメージングで定性評価できるほか、CSFのAβ42/Aβ40 ratioの低下を測定することで間接的に評価することもできる。CSF AβとAβ PETの一致と不一致は横断的および縦断的に調査されている。異なるグループが異なるコホートに対して、CSF Aβ42を用いるよりもCSF Aβ42/Aβ40 ratioを用いたほうがAβ PETとの良い一致率を示すことを実証した。しかしながら、CSF Aβ (CSF Aβ42/Aβ40 ratio または CSF Aβ42単独) または Aβ PET のどちらかが先行して陽性となることがある。我々の研究室と他のグループの発見をまとめると、CSF Aβのみが陽性となる個人 (CSF+/PET-) または Aβ PETのみが陽性となる個人 (CSF-/PET+) は、両方陰性 (CSF-/PET-) または両方陽性 (CSF+/PET+) の個人と比較して、異なる初期のアミロイドーシスステージにある可能性がある。これは、2つの異なるAβ病理進行経路を表現しているかもしれない (経路1: CSF−/PET− → CSF+/PET− → CSF+/PET+、経路2: CSF−/PET− → CSF−/PET+ → CSF+/PET+)。特筆すべきことは、本研究で述べるこうした「Aβ経路」は、Aβ病理の異なる生物学的メカニズムを表現しているのではなく、異なる病理進行シークエンスを示しているということである。
さらに、Aβ病理はアルツハイマー病の発症における初期役割を果たしており、これが引き続くtauの増加を招く可能性がある。Braak I-VIステージは、剖検データに基づく皮質神経原線維変化 (NFT) の空間的パターンを特徴づけるために提唱された。PETイメージング研究は、皮質NFTが初期には嗅内皮質に存在し、これが十分なAβ負荷の存在下でBraak III/IV およびBraak V/VI皮質領域に広がるというさらなるエビデンスを提供した。しかしながら、異なるAβ経路をたどる個人が異なる皮質タウ凝集パターンを有するのかどうかについて、いまだはっきりしたことはわかっていない。皮質NFTの空間的分布を調査することは、異なるステージにあるAD病理の特徴を理解することに重要であり、ADにおける抗タウ臨床試験のデザインにおける新たな知見を提供する可能性がある。
この研究では、我々は同時 (1年以内) のCSF Aβ42/Aβ40、phosphorylated tau (p-Tau)、Aβ PET、tau PETデータが存在する非認知症ADNI参加者を対象とし、これらをCSF Aβ42/Aβ40とAβ PETの異常に基づいて4つの異なるCSF/PETアミロイドーシスステージに分類した。異なるアミロイドーシスステージにおける皮質NFTの空間的パターンを調査するために、我々は異なるCSF/PET Aβステージにおいて有意なタウ上昇を伴う皮質領域を決定し、初期 (CSF+/PET- と CSF-/PET+) と 後期 (CSF+/PET+) アミロイドーシスステージにおけるCSF Aβ42/Aβ40、Aβ PET、CSF p-Tau/Aβ40と領域ごとおよびボクセルごとのタウPET画像を関連付けた。
2. 方法
2-1. 参加者
238人の認知機能正常 (cognitively unimpaired, CU) と77人のMCIで、18F-flortaucipir (FTP) tau PET、amyloid [18F-florbetapir (FBP) or 18F-florbetaben (FBB)] PET、CSF Aβ42、Aβ40、CSF p-Tau の同時 (1年以内) データが存在するADNI参加者。この315人の参加者をCSF-/PET-、CSF+/PET-、CSF-/PET+、CSF+/PET+に分けた。なお、non-Alzheimer's tauopathyの影響をコントロールするために、CSF-/PET-参加者の中でCSF p-Tau/Aβ40が異常な個人またはFTP tau PETが異常な個人 (嗅内皮質または側頭葉metaROI) は除外され、残りのCSF-/PET-参加者は対照群 (Ref) と定義された。
2-2. PETイメージングと解析
アミロイドPETのトレーサーはFBPまたはFBBを用いた。SUVRは全小脳集積に対する比として計算した。前頭葉、帯状回、頭頂葉、側頭葉の皮質領域をCOMPOSITE cortical areaとしてCOMPOSITE SUVRを計算した。
COMPOSITE領域のFBB Aβ陽性をSUVR≧1.08、FBP Aβ陽性をSUVR≧1.11として、FBPおよびFBBのSUVRをCentiloidに変換した: Centiloid = (196.9 × SUVRFBP) - 196.03 または Centiloid = (159.08 × SUVRFBB) - 151.65。
タウPETのトレーサーはFTPを用いた。Desikan-Killiany atlasの68個の皮質ROIにおけるFTP集積を抽出し、さらに側頭葉metaROI (嗅内皮質、海馬傍回、紡錘状回、扁桃体、下側頭回、中側頭回) のSUVRを下部小脳灰白質集積に対する比として計算した。タウ蓄積を異なるBraak NFTステージで評価するために、Braak III/IV (側頭葉/辺縁系) およびBraak IV/VI (新皮質) における平均FTP SUVRsを計算した。
2-3. CSFバイオマーカー
CSF Aβ40、Aβ42、p-Tau181データを用いた。CSF p-Tau/Aβ40比は、CSF p-Tauを単独で用いるよりもCSF産生に関連した測定値個人差を減らす可能性があり、またADバイオマーカーとの関連を改善する可能性があるため、今回の研究ではこちらを用いた。The CSF Aβ42/Aβ40 ratio と CSF p-Tau/Aβ40 ratio の閾値はそれぞれ ≤0.054 と ≥0.0012 を用いた。
3. 結果
3-1. 参加者特性
本研究で解析した参加者の特徴は表1に認められる。大部分がCSF-/PET- (Ref群) であり (49.3%)、2番目に大きな群はCSF+/PET+ (35.6%) であった。不一致群として、CSF+/PET- (6.6%) とCSF-/PET+ (8.5%) は同様の比率であった。CSF+/PET+は他のすべての群と比較して有意に高齢で、APOE ε4キャリアおよびMCIの割合が高く、CSF Aβ42/Aβ40が低く、Aβ PET Centiloidsが高く、CSF p-Tau/Aβ40が高かった。CSF-/PET+群はRef群と比較して有意に高年齢であった。CSF+/PET-とCSF-/PET+の両群ともに、Ref群と比較して有意に低いCSF Aβ42/Aβ40 ratio、高いAβ PET Centiloids、高いCSF p-Tau/Aβ ratioを示した。

表1. 異なるCSF/PET群の参加者における特性
3-2. CSF/PET群ごとの皮質タウ上昇
図1で示すように、CSF+/PET-群はRef群と比較して左嗅内皮質と海馬傍回に有意に高いタウ蓄積を示し、また効果量は限られるものの左上側頭溝縁 (BANKSSTS) にも同様のことが認められた (t=2.09、P=0.037)。対照的に、CSF-/PET+群はRef群と比較して、一部のBraak IVステージROI (両側前帯状回尾部、前帯状回吻側、後帯状回、島) とほとんど全てのBraak V/VIステージROI (前頭極、眼窩部、外側後頭回、下頭頂小葉、BANKSSTS、楔部) に有意に高いタウ上昇を示した。CSF+/PET+群はRef群と比較して全ての皮質領域で有意に高いタウ上昇を有した。

図1. 異なるCSF/PET群の有意な皮質タウ上昇: (A) 腰椎穿刺とAβ PETイメージングのイラスト。(B) タウPETイメージングのイラスト。(C) CSF Aβ42/Aβ40とAβ PETによって定義されるCSF/PET群のイラストと、CSF Aβ42/Aβ40の対応する閾値 (0.054) を示す赤い縦破線。(D-F) 異なるCSF/PET群におけるCSF-/PET-群と比較した有意な皮質タウ上昇。CSF+/PET-群とRef群の間の比較を除き、Benjamini-Hochberg approach (FDR<0.05) を用いた68 ROIsに対する多重比較補正を行った。
3-3. 異なるCSF/PET群のタウ蓄積の比較
図2に示されるように、CSF+/PET-群はRef群と比較して嗅内皮質の高いFTP SUVRを有した (P=0.012) が、Braak III/IVおよびBraak V/VIではそうではなかった。対照的に、CSF-/PET+群はRef群と比較してBraak V/VIで高いFTP SUVRを有した (P=0.004) が、嗅内皮質とBraak III/IVではそうではなかった。CSF+/PET+群はRef群と比較して嗅内皮質 (P<0.001)、Braak III/IV (P<0.001)、Braak V/VI (P<0.001) で高いFTP SUVRを有した。
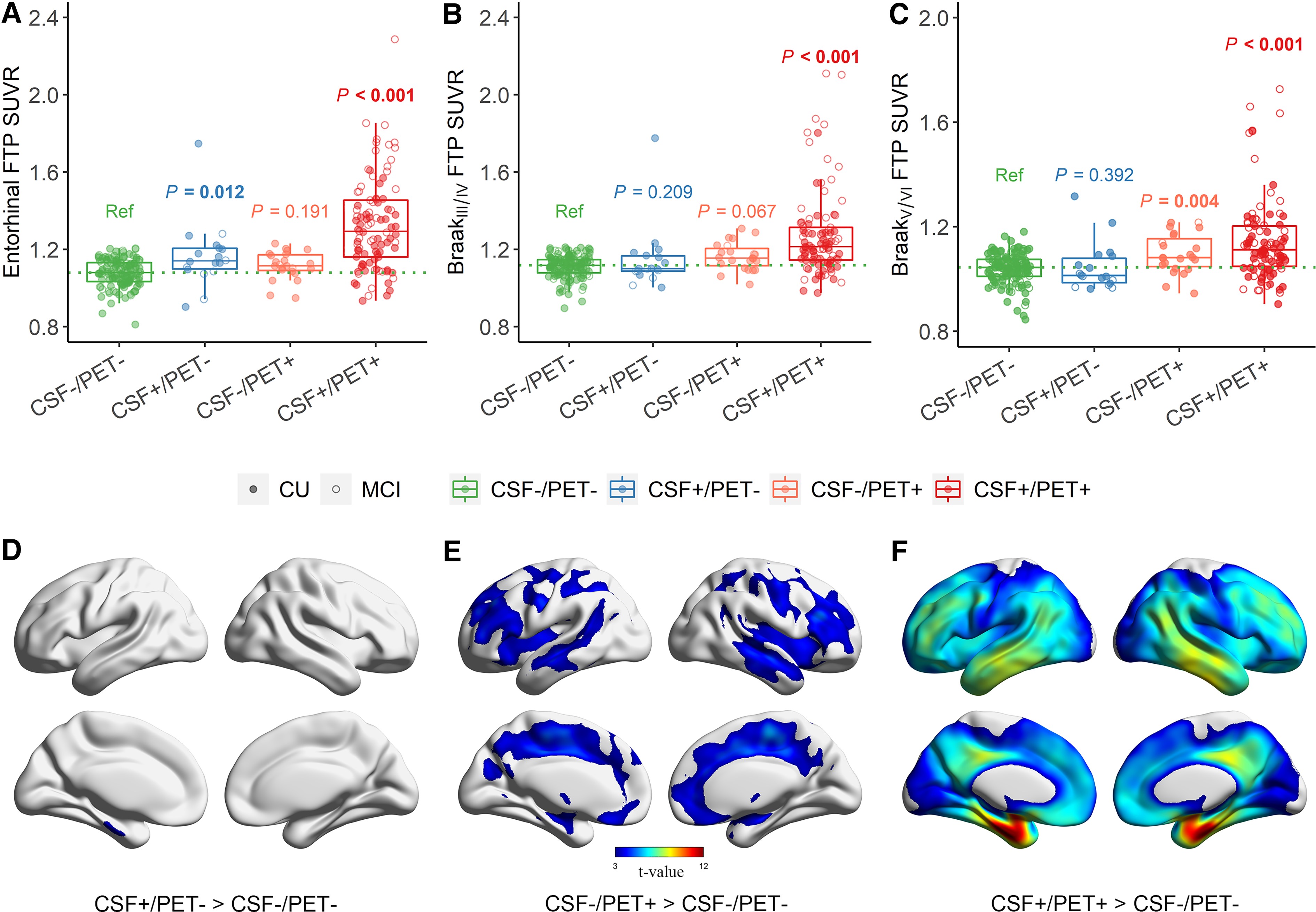
図2. 異なるCSF/PET群の皮質タウ蓄積の比較: (A) 嗅内皮質、(B) Braak III/IV、(C) Braak V/VI におけるFTP SUVRsを異なるCSF/PET群で比較したもの。箱ひげ図のひげは、第1および第3四分位から、IQRの1.5倍の範囲内で最も低いまたは高いデータポイントまで広がっている。ドットは各CSF/PET群内の各参加者のデータを表している。緑色の破線はRef群の中央値を表している。バー先端の値はRef群と比較したP値を示している。(D) CSF+/PET-、(E) CSF-/PET+、(F) CSF+/PET+ のボクセルごとのタウPET画像の比較。二票本のt検定を用いて、CSF+/PET-群とRef群の比較はP<0.001の閾値を用いて、その他の比較はP<0.001の閾値を用いて表示し、family-wise errorはP<0.05で補正した。
ボクセルごとの解析では、CSF+/PET-群はRef群と比較して左嗅内皮質と海馬傍回に高いタウPET集積を示した (図2D、P<0.001) が、CSF-/PET+群はRef群と比較してBraak IVステージROIs (両側前帯状回尾部、前帯状回吻側、島、後帯状回、帯状回峡部) とほとんどのBraak V/VIステージROIs (両側内側眼窩前頭部、中前頭回尾部、中前頭回吻側、上側頭回、楔前部、中心前後回) (図2E、P<0.001) に高いタウPET集積を示した。さらに、CSF+/PET+群は鳥距溝周囲と楔部を除くほとんどの皮質領域でタウ上昇を示した (図2F、P<0.001)。
極端に高い嗅内皮質FTP SUVRを示した2人を除いても、CSF+/PET-群はRef群と比較して依然として左嗅内皮質に有意に高いタウ蓄積を有し、他の比較も概ね同様であった。さらに、CSF Aβ42/Aβ40とAβ PETの閾値から±5%以内の個人を除いても不一致群はそれぞれ異なった皮質タウ蓄積を示した。
3-4. 早期および後期アミロイドーシスステージの皮質タウとCSFバイオマーカーおよびAβ PETの関連
初期アミロイドーシスステージでは、CSF Aβ42/Aβ40の低値は嗅内皮質のFTP SUVRの高値と関連していた (P=0.004) が、Braak III/IVまたはBraak V/VIのFTP集積とは関連していなかった (図3A、D、G)。一方でAβ PETの高値はBraak III/IV (図3E、P=0.002) とBraak V/VI (図3H、P<0.001)におけるFTP SUVRの高値と関連していたが、嗅内皮質のFTP集積とは関連していなかった。しかし、我々はCSF p-Tau/Aβ40と嗅内皮質、Braak III/IVおよびBraak V/VIにおけるtau PET集積の間に正の関連性を認めた (図3C、F、I)。
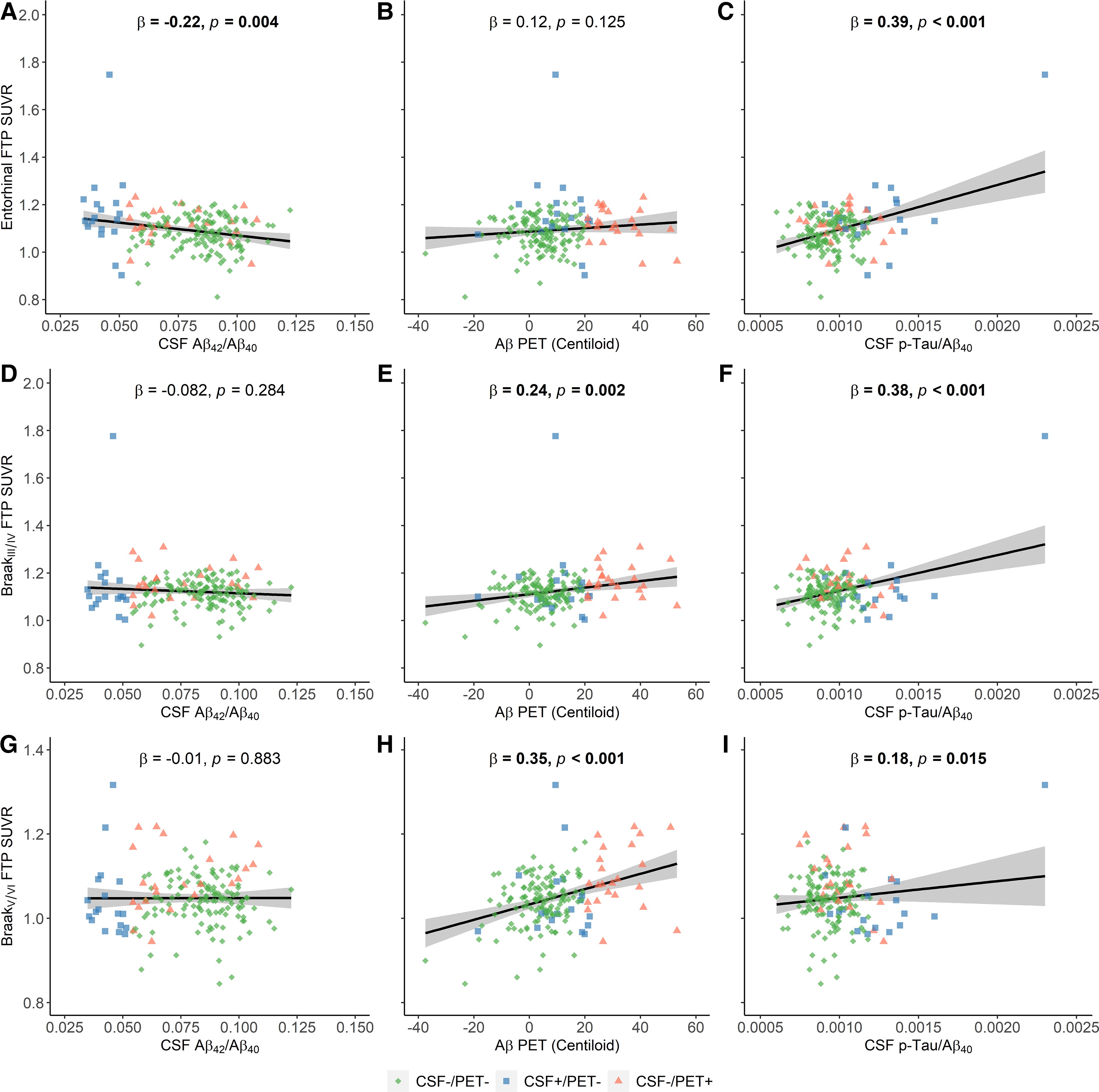
図3. 早期アミロイドーシスステージの皮質タウ蓄積とCSF Aβ42/Aβ40、Aβ PET、CSF p-Tau/Aβ40の関連性: 嗅内皮質のFTP SUVRと (A) CSF Aβ42/Aβ40、(B) Aβ-PET(Centiloid)、(C) CSF p-Tau/Aβ40 の間の関係性。Braak III/IV FTP SUVRと (D) CSF Aβ42/Aβ40、(E) Aβ-PET (Centiloid)、(F) CSF p-Tau/Aβ40 の間の関係性。BraakV/VI FTP SUVR と (G) CSF Aβ42/Aβ40、(H) Aβ-PET(Centiloid)、(I) CSF p-Tau/Aβ40 の間の関係性。
後期アミロイドーシスステージでは、CSF Aβ42/Aβ40の低値は嗅内皮質 (図4A、P<0.001)、Braak III/IV (図4D、P<0.001)、Braak V/VI (図4G、P<0.001) のFTP SUVRの高値と関連していた。また、Aβ PETの高値は嗅内皮質 (図4B、P<0.001)、Braak III/IV (図4E、P<0.001)、Braak V/VI (図4H、P<0.001) のFTP SUVRの高値と関連していた。さらに、CSF p-Tau/Aβ40は嗅内皮質 (図4C、P<0.001)、Braak III/IV (図4F、P<0.001)、Braak V/VI (図4I、P<0.001) のFTP SUVRの高値と関連していた。
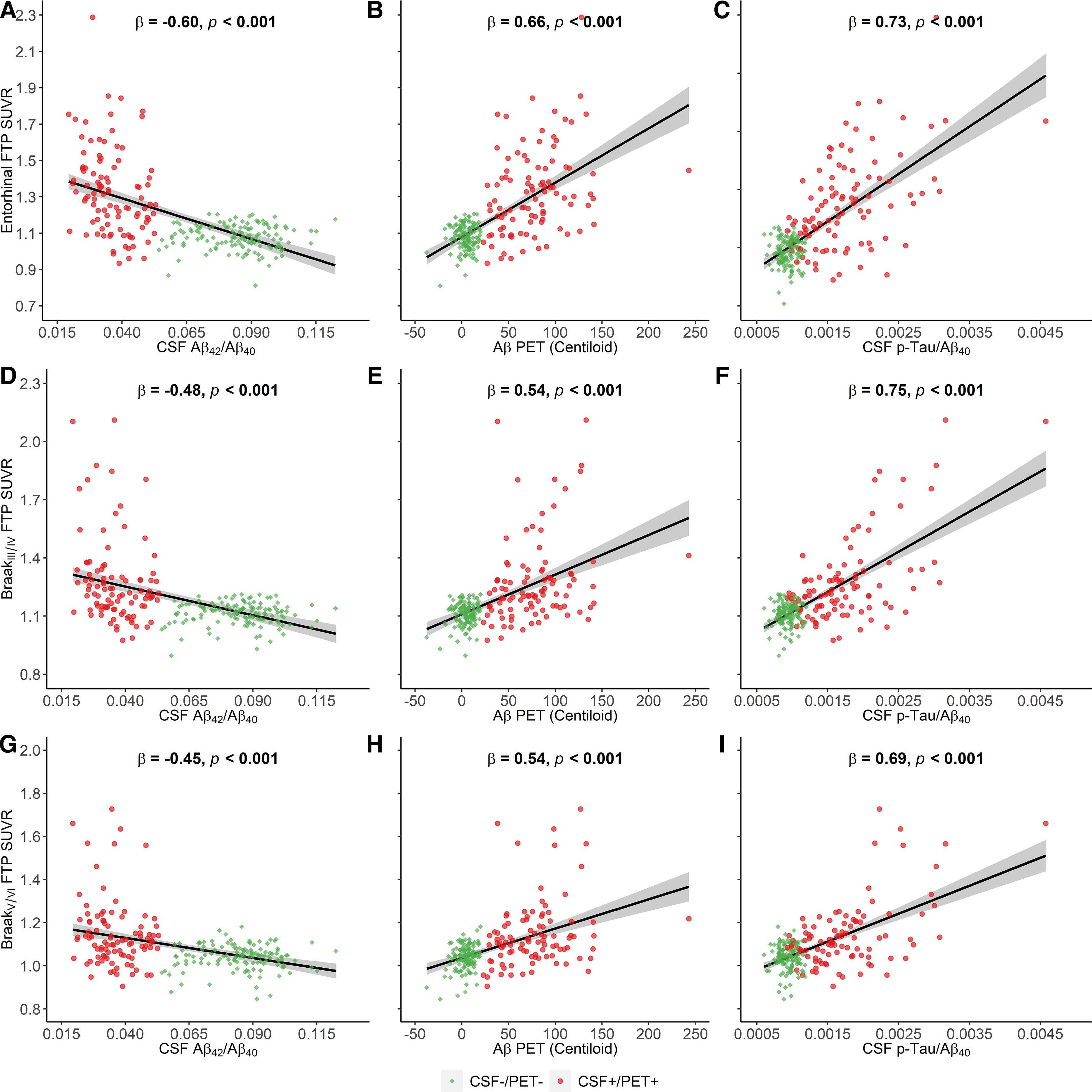
図4. 後期アミロイドーシスステージのCSF Aβ42/Aβ40、Aβ PET、CSF p-Tau/Aβ40と皮質タウ蓄積の関連: 嗅内皮質FTP SUVRと (A) CSF Aβ42/Aβ40、(B) Aβ-PET(Centiloid)、(C) CSF p-Tau/Aβ40 の関連。Braak III/IV FTP SUVR と (D) CSF Aβ42/Aβ40、(E) Aβ-PET(Centiloid)、(F) CSF p-Tau/Aβ40 の関連。Braak V/VI FTP SUVR と (G) CSF Aβ42/Aβ40、(H) Aβ-PET(Centiloid)、(I) CSF p-Tau/Aβ40 の関連。
嗅内皮質FTP SUVRが極端に高値であった2人を除いたところ、早期アミロイドーシスステージのtau PETとCSF p-Tau/Aβ40の関連性は消失した。しかし、その他の関連性は保たれていた。さらに、ボーダーラインの個人を除いても結果はほとんど変化しなかった。
3-5. 早期および後期アミロイドーシスステージのボクセルごとの皮質タウ蓄積とCSFバイオマーカーおよびAβ PETの関連性
早期アミロイドーシスステージでは、CSF Aβ42/Aβ40の低値は左嗅内皮質のFTP SUVRの高値と有意に関連しており (図5A)、Aβ PET Centiloidは右島、両側帯状皮質、中心溝周囲、前頭葉、頭頂葉皮質のFTP SUVRの高値と関連しており (図5C)、CSF p-Tau/Aβ40は左嗅内皮質、海馬傍回、紡錘状回、下側頭回、中側頭回、BANKSSTS のFTP SUVRの高値と関連していた (図5E)。一方で、後期アミロイドーシスステージではCSF Aβ42/Aβ40、Aβ PET、CSF p-Tau/Aβ40はすべてのBraak ROIsのFTP SUVRと有意な関係性を示し、さらにFTP SUVRとCSF p-Tau/Aβ40の間には最も強い関連性が認められた (図5B、D、F)。さらに、後期アミロイドーシスステージでは早期Braak ROI (嗅内皮質とBraak III/VI) のtau PETとすべてのバイオマーカーの間に最も強い関連性が認められた。
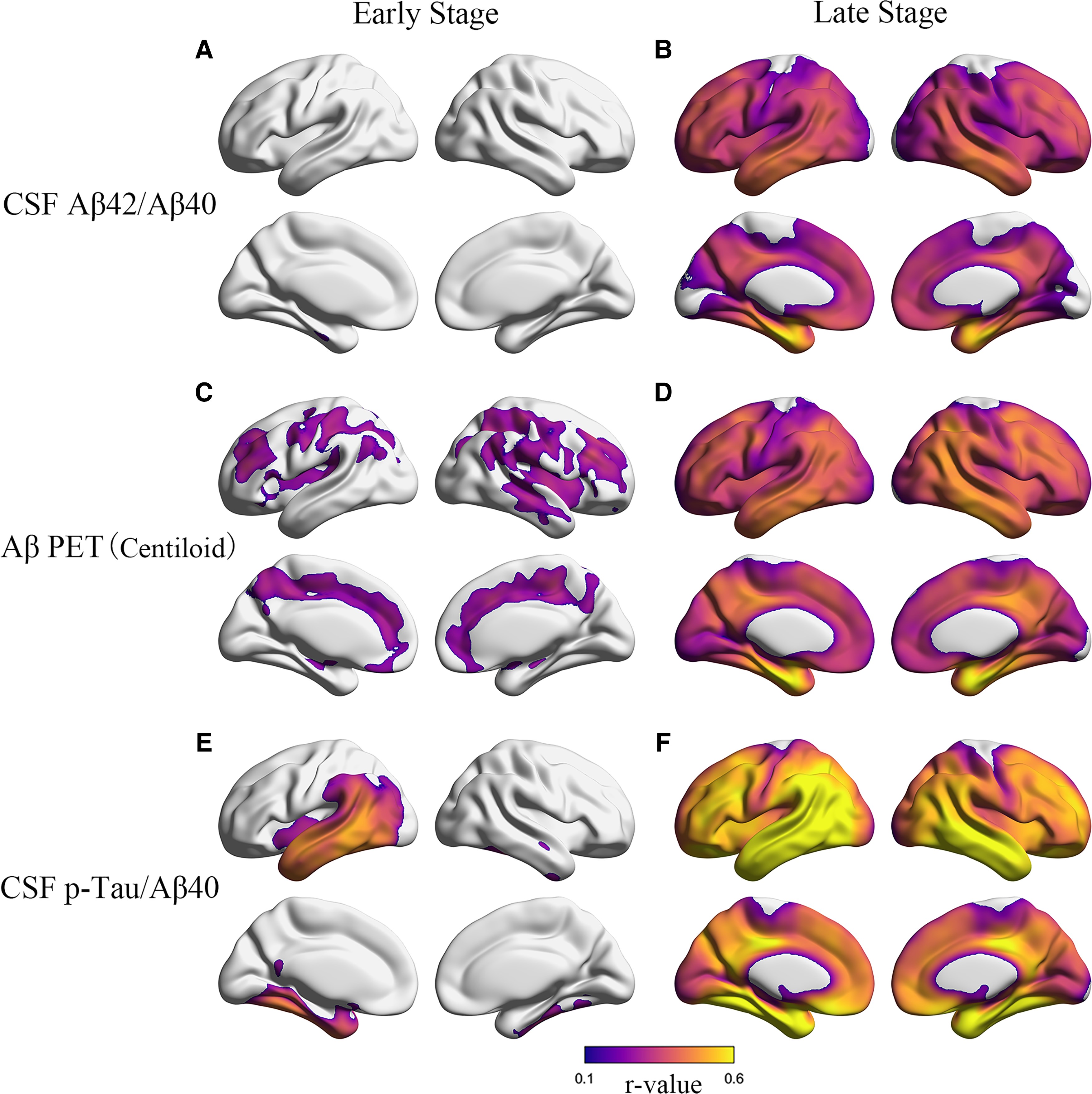
図5. 早期および後期アミロイドーシスステージにおけるボクセルごとの皮質タウとCSFバイオマーカーおよびAβ PETの関連性: 早期アミロイドーシスステージにおけるFTP SUVRと (A) CSF Aβ42/Aβ40、(C) Aβ PET、(E) CSF p-Tau/Aβ40 のボクセルごとの関連性。CSF Aβ42/Aβ40 については P < 0.005 を表示し、他の解析は P < 0.001 を表示した。FTP 後期アミロイドーシスステージにおけるFTP SUVRと (B) CSF Aβ42/Aβ40、(D) Aβ PET、(F) CSF p-Tau/Aβ40 のボクセルごとの関連性。すべての結果はP < 0.001 で表示した。
極端に高い嗅内皮質FTP SUVRを示した2人を除くと、早期アミロイドーシスステージにおけるタウPETとCSF p-Tau/Aβ40の関連性は消失した。しかし、他の関連性は保たれていた。さらに、ボーダーラインの個人を除いても結果はほとんど変化しなかった。
4. 考察
本研究では、認知症のない高齢者において、CSF Aβ42/Aβ40とAβ PETで定義された異なるアミロイドーシスステージについて、タウPETイメージングで測定された皮質タウ沈着を調べた。CSF Aβ42/Aβ40陰性およびAβ PET陰性 (CSF-/PET-) でCSFや大脳皮質にタウの増加がない人と比較して、CSF Aβ42/Aβ40のみ異常の人 (CSF+/PET-) は、Braak III/IVおよびBraak V/VIではなく、嗅内皮質で高いタウ蓄積を示したが、Aβ PETのみ異常の人 (CSF-/PET+) は、嗅内皮質およびBraak III/IVではなく、BraakV/VIで有意なタウの上昇を示した。ボクセルごとの解析から、CSFのAβ42/Aβ40の低値は、嗅内皮質のタウの高値と関連し、一方、Aβ PETの高値は、アミロイドーシス初期 (CSF+/PET-およびCSF-/PET+) のBraak V/VI ROIにおけるタウの高値と関連していることが、さらなる証拠となった。対照的に、CSF Aβ42/Aβ40に異常があり、Aβ PETにも異常がある個人 (CSF+/PET+) は、すべてのBraak ROIで有意なタウ上昇を示し、CSF Aβ42/Aβ40の低下とAβ PETの上昇は、アミロイドーシス後期では、嗅内皮質、Braak III/ IV、Braak V/VIのタウ上昇と相関していた。これらの知見は、アルツハイマー病の異なるアミロイドーシスステージにおける皮質タウ凝集を理解するための新たな洞察を提供し、脳脊髄液AβとAβ PETの不一致者は、アルツハイマー病の初期アミロイドーシスステージにおいて、異なる皮質領域に初期タウ凝集を有する可能性を示唆した。
先行研究と同様に、CSF+/PET-個人 (CSF-first Aβ経路) とCSF-/PET+個人 (PET-first Aβ経路) は同程度の割合であり、両者ともCSF-/PET-個人よりもCSFまたはPET画像で測定されたAβ病理が多かったことから、CSF AβとAβ PETはAβ病理の異なる特徴を測定している可能性があり、アルツハイマー病の初期アミロイドーシスステージには2つの異なるAβ経路が存在することが支持された。さらに、CSF+/PET-個人とCSF-/PET+個人はともに、CSF-/PET-個人よりもCSF p-Tau/Aβ40比が高く、CSFにおける初期の異常なタウの増加がアミロイドーシス初期に検出可能であることを示唆している。注目すべきことに、CSF+/PET-個人はCSF-/PET+個人よりもCSF p-Tau/Aβ40比が高いことも示された。これらの所見を総合すると、CSF-first Aβ経路 (CSF-/PET- → CSF+/PET- → CSF+/PET+) は、PET-first Aβ経路 (CSF-/PET- → CSF-/PET+ → CSF+/PET+) よりも、アルツハイマー病の初期に典型的にみられる可溶性アルツハイマー病の病態生理を有する可能性が示唆された。
CSF p-Tauは初期のtauの上昇を補足するものの、PET画像はタウ蓄積に関する空間的情報を提供する。特に、我々のグループと他の研究室はつい最近CSF p-TauがタウPETイメージングよりも早期のタウ上昇を検出できる可能性を観測し、これは剖検研究でもサポートされた。重要なのは、横断解析と銃弾解析の両方で、CSF-first Aβ経路がAβ関連タウ蓄積を嗅内皮質 (タウの最早期蓄積部位) に有していたことを示せたことである。対照的に、PET-first Aβ経路は嗅内皮質やBraak III/IV ではなくBraak V/VIにAβ関連タウ上昇を有していた。我々の結果と合致して、最近のADNI研究はCSF+/PET-とCSF-/PET+個人がCSF-/PET-個人と比較して、ベースラインから5年後のタウPET画像で数値的に高い (有意ではない) および低い嗅内皮質タウを有していたことを報告した (ただしこの研究はCSF Aβ42を用いてAβ状態を評価しており本研究より信頼性が劣るかもしれない)。また彼らはCSF-/PET+は嗅内皮質やBraak III/IVではなくBraak V/VIにおける有意なタウ蓄積を有することを報告しており、我々の報告と合致する。我々の結果と先行研究を総合すると、PET-first Aβ経路の個人は、早期Braakステージの皮質領域におけるタウ伝播に重要なCSF p-Tauが低いことに由来して、嗅内皮質とBraak III/VI皮質領域にタウ蓄積を認めている可能性がある。早期アミロイドーシスステージのボクセルごとの解析からは、CSF Aβ42/Aβ40が嗅内皮質におけるタウ蓄積と関連しており、一方皮質Aβ負荷がBraak V/VIステージの皮質タウ蓄積と関連していることが想定された。特に、CSF-/PET+個人はCSF+/PET-個人と比較してCSF p-Tau/Aβ40が低く、ここからCSF-/PET+個人ではCSF p-TauをBraak V/VIタウ上昇を表すバイオマーカーとして使用することはできないことが想定された。
我々のグループや他の研究室では、CSF+/PET-でもCSF+/PET+と同程度の割合で皮質Aβ負荷が蓄積しており、将来的にはCSF+/PET+になることが観察されている。また、これまでの報告によると、CSF-first Aβ経路は PET-first Aβ経路よりも高頻度に観察されている。本研究では、CSFとPETのAβ不一致群の割合が同程度であったが、これまでの縦断的解析でも、CSFのAβがPETのAβよりも早く異常化する可能性が支持されている。その結果、おそらく、CSF-first Aβ経路は、アルツハイマー病の典型的な進展を示しており、アルツハイマー病の典型的なタウ拡散パターンを示している。一方、PET-first Aβ経路は、アルツハイマー病の初期アミロイドーシス段階において、皮質Aβ負荷に関連した海馬のタウ上昇を示している可能性がある。ヒト脳におけるアルツハイマー病関連タウ沈着の検出には、Temporal-metaROI複合領域が一般的に用いられてきた。しかし、我々の知見は、PET-first Aβ経路を有する個人においては、アミロイドーシス初期の皮質タウ増加を捉えるためにTemporal-metaROI領域を使用できない可能性を示唆し、初期アルツハイマー病における初期のタウ増加を検出するために異なる皮質領域を選択すべきであることを示唆した。
対照的に、CSF Aβ陽性者およびAβ PET陽性者 (CSF+/PET+、アミロイドーシス後期) は、対照群よりもすべての皮質領域で有意なタウ上昇を示し、最も高いタウ上昇をTemporal-metaROI複合領域で認めた。さらに、ボクセルごとの解析では、CSFのAβ42/Aβ40の低値、Aβ PETの高値、CSFのp-Tau/Aβ40比の大小が、すべての皮質領域における有意なタウ上昇と関連しており、Temporal-metaROI複合領域が最も強い関連を示した。これらの所見は、CSFとPETのAβが一致した人において、皮質のタウ増加を検出するためにTemporal-metaROI領域を用いることが妥当であることを示唆している。
5. 結論
結論として、我々は、CSFとPETのAβ不一致者は、認知症のない高齢者において、皮質のタウ沈着パターンが異なることを見出した。最近の研究から、アルツハイマー病ではタウの拡がりパターンに明確な生物学的特徴がある可能性が示唆されており、これはタウに関連した神経変性と認知機能低下の不均一性を説明し、抗タウ臨床試験をデザインする上で重要である。我々の知見は、アルツハイマー病におけるタウ拡散パターンのサブタイプを理解するのに有用であり、初期アミロイドーシスの段階にある個人における皮質タウ検出のための新たな基準を提供するものである。
感想
こういう、総Nは大きいけど対照例はほんの数%のため結局case series的になってしまう研究、自分も似たようなことを今やってるので筆者らのもどかしさがよくわかる...。CSF+/PET-群とCSF-/PET+群を比較したFigureを見てみると (もちろん有意差は出ているものの) そんなにきれいに視覚的に差のあるデータとは言えず、もう少しNがいたらよかったのになあという感想。あと基本的にRef群と比較してるけどCSF+/PET-群とCSF-/PET+群の直接比較はnegative dataになっちゃったんだろうなあ。