Biomarkers in Alzheimer’s disease: role in early and differential diagnosis and recognition of atypical variants.
Dubois, Bruno, et al.
Alzheimer's Research & Therapy 15.1 (2023): 175.
Common diseaseを勉強しないと...。
1. 背景
アルツハイマー病 (AD) は認知症の最も一般的な形態であり、全体の約2/3を占める。全世界における未診断の認知症患者の数は4100万人に上ると推定されており、臨床的に同定されているのはせいぜい25%程度であろうと考えられている。多様な病態生物学的サブタイプと臨床表現型を持つ神経変性疾患であるADは、凝集アミロイドβ (Aβ) から成るAβプラークと凝集タウ蛋白から成る神経原線維変化を含む神経病理学的変化によって定義される。これらの神経病理学的変化は、シナプスと神経細胞の脱落、伝達物質の欠乏、神経炎症、反応性アストログリオーシスと関連しており、最終的には認知機能障害を前く。
ADの典型的な臨床表現型は、潜行性に発症し緩徐に進行する健忘型の認知機能障害であり、全体の約85%を占めるが、AD病理を伴う患者で非健忘型の認知機能障害をきたす少数の患者も重要である。ADの診断は病態生物学、遺伝的因子、脳脆弱性、結果的な臨床表現型 (e.g. lvPPA、PCA、CBS、frontal AD) などの異種性によって困難なことがある。AD病理は、特に加齢脳では他の神経変性疾患および血管障害と共存することが多く、このため適切なケア、サポート、個別化治療のためには適切なタイミングでの鑑別診断が必要不可欠である。
症状の発症とADの診断の間の平均時間は約2.8年であり、患者は診断時点ですでに疾患後期にまで進行してしまっている可能性もある。AD患者の認知機能障害の重症度にはスペクトラムがあり、疾患経過の異なるステージが定義されており、これには preclinical期 (AD病理のバイオマーカーは存在するが、認知機能障害は存在しないかあっても軽微である)、prodromal期 (MCI due to AD)、軽症認知症、中等症から重症の認知症が含まれる。
早期診断は、利用可能な対症療法の恩恵を最適に受けるために重要である。さらにADに対する新規の疾患修飾治療 (disease-modifying treatments, DMTs) が現在承認されており、また開発中のものもある。これらは疾患の初期段階で最も効果的であると考えられており、臨床所見も初期AD (MCI due to ADまたは初期のAD dementia) の参加者に焦点を当てている。このため、ADの早期診断はより一層重要である。たとえば、凝集Aβを標的としたモノクローナル抗体であるaducanumabが、最近米国のFDAで初期ADの治療のために承認された。さらに、ADの治療のために現在開発されているその他の複数の治療薬は、今後臨床使用が可能になるかもしれない。
ADの生体内バイオマーカーの使用は、ADの診断をより早期化し、発症前診断の可能性をも生み出した。最近のIWGの推奨によれば、臨床現場におけるADの診断は、特定のAD表現型と支持的バイオマーカー所見のある人々に対してのみ下されるべきであるとされている。このガイドラインは、バイオマーカー陽性の認知機能正常者は、AD dementiaへの進行のリスク状態であると考えられるべきだと主張した。臨床診断は臨床表現型に基づいているため、特に初期段階における鑑別診断や異なるAD表現型の鑑別に有用なバイオマーカーはますます増加してきており、またこれらは症候性ADのリスク状態の同定の助けにもなっている。このレビューでは、我々は典型的および非典型的ADの早期診断に有用な臨床表現型とバイオマーカーの使用について議論し、これらがどのように臨床的な意思決定、患者とのコミュニケーション、患者の予後改善をサポートするのかについて記載する。
2. ADの臨床表現型
ADのもっとも典型的な臨床表現型は健忘症候群である (約85%)。より一般的でないADの表現型には、lvPPAやPCAがある。その他の非典型的な表現型にはCBS、行動または遂行機能障害型のfrontal AD、その他のバリアント (e.g. nfvPPA、svPPA) が含まれている。報告された臨床サンプルにおける典型的および非典型的なAD臨床表現型の割合は、図1に示される通りである。
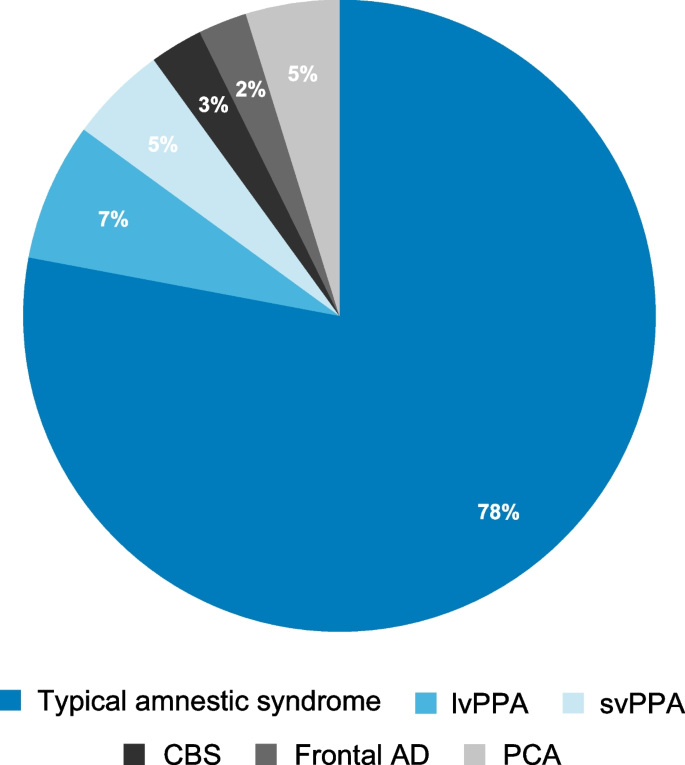
図1. 臨床サンプルにおけるADの典型的及び非典型的臨床表現型: この臨床サンプルは認知症専門クリニックを訪問してADと診断された連続症例523人から構成されている。42人の患者がMCIであり、パイチャートには含まれんかあった。言語症状を呈した症状はほとんどがlvPPAと考えられたが、nfvPPAであった可能性も否定できない。
一般に、健忘症候群は新規獲得情報の学習と再生の障害によって特徴づけられ、意味キューを用いて評価される (e.g. 情報の効果的符号化とその想起の容易化に関する制御学習タスクを組み込んだ Free and Cuet Selectiev Reminding Test)。健忘症候群の患者は自由再生と総再生がどちらも低下する (e.g. キュー効果の低下と再認の障害) ため、情報がそもそも貯蔵されない上に想起が容易化されないことが示されている。
lvPPA患者は、単一単語想起障害、文章復唱障害、運動性発話能力障害 (音素性錯語を含む) を呈する。PCAは (視覚性注意障害またはBalint症候群を伴う) 視空間および視知覚能力の障害、失算や失読を特徴とし、視覚処理の背側および腹側経路を含む両側の後頭頭頂皮質の機能障害を反映していると考えられている。
CBSは錐体外路症状としての筋強剛や、ミオクローヌス、眼球運動および四肢の失行、皮質性感覚障害、他人の手徴候によって特徴付けられる。Frontal ADは前頭葉性の行動障害や遂行機能障害が突出した進行性の臨床症候群である。Frontal ADの行動および遂行機能障害バリアントを有する患者の半分以上が、初期には行動変化よりも認知機能障害を先に呈したことが報告されており、一部には運動症状や、行動/認知/運動症状の混合を呈した例もあることが報告されている。行動症状は、アパシー、脱抑制、共感性の喪失、また一般的ではないが保続的または強迫的行動、口唇傾向、食習慣の変化などを含む。一方で遂行機能障害バリアントは、ワーキングメモリや認知的柔軟性などの中核的遂行機能の低下を主とする。nfvPPAやsvPPAといった原発性進行性失語は、AD病理と関連している可能性は低い。lvPPAのうち86%がADによるものであったが、nfvPPAは20%、svPPAは16%を占めるのみであった。ADの異なる表現型と関連する臨床症状は表1にまとめられている。


表1. ADの異なる表現型の臨床特徴
ADの臨床表現型は、α-synuclein、TDP-43、non-AD tauopathyや血管病変といった共存病理によって影響を受け、共存病理は年齢とともに増加する。共存病理の存在は臨床症状の強さや多様性をより強調する。ほとんどのnon-AD神経変性疾患に対するバイオマーカーは未だ利用可能でないことから、これらの疾患とADを分離することは、バイオマーカーに支持された表現型の同定か、死後脳調査に依存する。この状況下で、ADの非典型的および典型的表現型は正規のバイオマーカーを有する; 分子神経イメージングと体液バイオマーカーは生体内でのAD病理を確認するために用いることができる。
3. 典型的および非典型的AD表現型のバイオマーカープロファイル
ADバイオマーカーの大部分は、病態生理学的バイオマーカーとトポグラフィックバイオマーカーに分類することができる。両者はともにAD表現型を分類するために役立つ。ADに関連する病態生理学的バイオマーカーには、アミロイドPET、アミロイドやタウのCSF濃度、アミロイドやタウまたは他の蛋白バイオマーカーの血漿中濃度がある。トポグラフィックバイオマーカーは、AD病理の領域的特徴と関連しており、たとえばFDG-PETの低代謝領域、tau PET、構造的MRIにおける領域的/局所的萎縮などが挙げられる。
現在、個々のAD臨床表現型と関連した体液バイオマーカーは発見されていない。しかし、領域分布の違いに由来して、対応する分子/代謝/神経変性イメージングバイオマーカーが存在する (図2)。既存文献は主にAD病理のバイオマーカーに集中しており、これらを利用する主要な臨床的価値は、ADとnon-AD病理に関連した表現型を見分けることや、リン酸化タウ (pTAU) の血漿およびCSF濃度などの背景生物学の変化を測定することにある。現在、AD表現型を十分な診断精度で区別することができる単一バイオマーカーまたはバイオマーカーアルゴリズムは存在せず、臨床的評価の重要性が強調される。

図2. ADの異なる臨床表現型の期待されるバイオマーカー結果: Aβプラークの増加のエビデンスは表現型を問わずに認められるため、血漿Aβ42/40比の低下はあらゆる臨床表現型で認められる。
4. PETマーカー
様々なリガンドを用いたPETイメージングは、ADの典型的および非典型的臨床表現型の背景病理を同定するために臨床的に有用であり、他の神経変性疾患との鑑別診断の補助となる。ADの臨床表現型にわたるPETイメージングの例が示されている (図3)。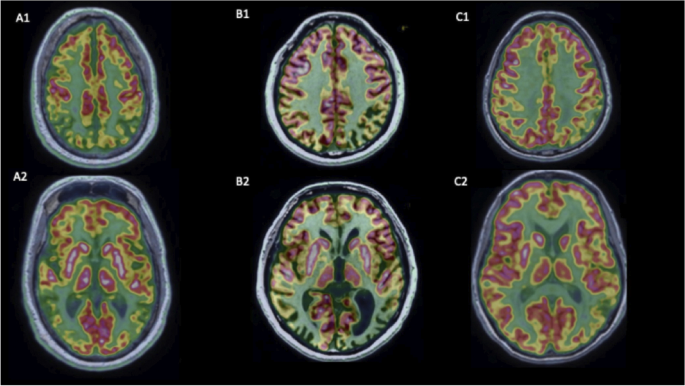
図3. ADの臨床表現型ごとのFDG-PET: A 典型的AD、B PCA、C lvPPA。Panel Aは典型的AD患者の対称性の両側頭頂側頭葉の低代謝を示す。Panel BはPCA患者の両側頭頂-側頭-後頭葉の代謝低下を示す。Panel CはlvPPA患者の左優位頭頂側頭領域の代謝低下を示す。
FDG-PETは、典型的ADと非典型的ADを特徴付けるのに役立つトポグラフィックバイオマーカーであり、ADの変種にわたる臨床的障害を反映した局所代謝低下パターンを示す。AD患者は典型的には、楔前部を含む頭頂葉と内側側頭葉に両側性の代謝低下を示す。この画像診断法は、レビー小体型認知症や前頭側頭型認知症 (FTD) など、non-AD dementiaに特徴的な代謝低下のパターンも検出できるため、鑑別診断が可能である。FDG-PETはMRIよりも大きな診断情報を提供するが、それほど広く使用されていない。
アミロイドPETは主に研究現場で使用され、脳内の線維状または不溶性のAβプラークを可視化するが、他の形態のAβペプチドは可視化しない。アミロイドPETは、アミロイドプラークを同定するための最も広範に検証されたバイオマーカーであり、画像診断から剖検までの研究において高い精度が実証されている (感度92%、特異度100%)。他の画像モダリティとは異なり、PETによって可視化されるアミロイド分布は、非典型的AD患者と典型的AD患者で類似している。
神経原線維変化を可視化するタウPETは、主に研究環境で使用されている。これは、剖検で検証された唯一の神経原線維変化の直接的マーカー (感度 92-100%, 特異度52-92%) であり、体液マーカーは同様の精度を示していない。アミロイドPETと比較して、タウPETは認知機能が低下していない人の認知機能低下を予測することが示されており、これらの人では短期間 (3-5年) の進行に関連するため、臨床的意義が高い。アミロイドPETとは対照的に、タウPETはトポグラフィ法であり、沈着パターンは臨床的表現型をより反映している。タウPETのリガンド結合は、PCAでは後頭葉領域で、lvPPAでは左前頭葉領域で、健忘型AD患者では内側側頭葉領域で大きいことが示されている。タウPETのパターンは、典型的 (健忘型) ADと非典型的ADで異なっており、これらの違いは、典型的と非典型的の表現型に対応する生物学を特徴付けるのに有用であるかもしれない。
ADの診断に役立つPETバイオマーカーとして現在研究されているものには、シナプス密度を調べるsynaptic vesicle glycoprotein 2A PETや神経炎症を調べるtranslocator protein PETなどがある。注目すべきは、これらのバイオマーカーは鑑別診断ではなく、疾患の病期分類と予後予測に役割を果たすということである。さらに、これらのPETトレーサーは臨床ではほとんど使用されていない。
5. MRIマーカー
MRIの変化はADのトップグラフィックバイオマーカーであり、AD患者の構造的MRIは灰白質の萎縮と体積減少を示し、神経変性を示す。連続的構造MRI画像は、単一構造MRIよりも分散が小さいため、疾患の進行を測定するためにしばしば使用される。構造MRIの連続測定により、従来の臨床評価よりも少ないサンプルサイズで臨床試験を実施できる可能性があるため、臨床において治療効果を評価できる可能性があることを示すデータもある。白質の損傷を評価する拡散テンソル画像MRI、脳の構造的変化に先行すると考えられている脳の機能的結合の変化を評価する安静時機能的MRI、血管活動を評価し脳アミロイド血管症を同定するT2強調または帯磁率強調MRIなどのMRI測定法がある。しかし、これらの検査法は、現在、臨床試験の大部分や日常臨床では使用されていないが、抗アミロイド薬の使用に伴い、アミロイド関連画像異常 (ARIA) を管理するためにますます重要になる可能性がある。
構造的MRIでは、典型的ADの萎縮は内側側頭葉から始まり、外側側頭葉と頭頂葉を侵すように進行するが、非典型的ADでは、萎縮は通常、臨床症状に対応する領域で最も顕著であり、初期段階では海馬は温存されることが多い。MRIにおける変化は、FDG-PETでみられるものと一致するが、通常、疾患進行の後期に現れる。健忘症候群患者のFree and Cued Selective Reminding Testの記憶スコアは、AD患者の構造的MRIで評価した海馬容積と相関することが示されている。
6. CSFバイオマーカー
CSFバイオマーカーはAβとタウペプチドを検出するために用いられ、ほとんどの患者ではこれらのバイオマーカーは神経イメージングバイオマーカーで変化が現れるよりも前に検出される。CSF tauは神経細胞死を示し、このためnon-AD dementiaや非典型表現型でも上昇する。pTauの上昇は、典型的および非典型的表現型の両方でAD病理により特異的である。CSFバイオマーカーは、Aβ (1–42) (Aβ42)、Aβ (1–40) (Aβ40)、pTau 181 (pTau181)、pTau 217 (pTau217)、and total tau (tTau) を含む。これらのマーカーは、pre-symptomaticおよびprodromal期からAD関連生物学的変化を正確に同定することが示されており、一部の研究では認知機能低下を予測する可能性が示されている。
CSF Aβ42濃度とAβ42/40比の低下はAβプラーク沈着の程度と逆相関し、tTauとpTauはそれぞれ神経変性の強度と神経原線維変化の強度と相関する。CSF Aβ42/40比の低下は典型的にはAD病理を示しており、これは非典型的臨床特徴のある患者や他のCSF所見が非典型であっても当てはまる。「FTD表現型」に関しては、行動および意味型のfrontal ADの両方の同定と、これらの患者とFTDとの鑑別に、pTau181/Aβ42比が有用であることが報告されている。CSF pTau 231 (pTau231) は、臨床的表現型によらない初期ADの診断に有用性が示され、また潜在性のAD病理の検出にも有用である。
一部のクリニックでは、ニューロフィラメント軽鎖 (NfL) がtTauに代わる高感度の神経変性体液バイオマーカーであることを報告している。AD診断の補助となる他の調査中のCSFバイオマーカーには、chitinase 3-like 1 (YKL-40)、glial fibrillary acidic protein (GFAP)、neurogranin、他のシナプスバイオマーカーがある。特に、これらのバイオマーカーは鑑別診断ではなく病期分類や予後予測に重要な可能性がある。
7. 血液バイオマーカー (Blood-based biomarkers, BBBMs)
BBBMは、ADに関連する病理を同定するための重要なツールとして台頭してきている。血液中のAβペプチドとpTauの濃度は、CSF中の対応する濃度やPET陽性との関連を示している。血漿中のAβ42/40比を測定するアッセイは、米国で市販されており、ADの全段階におけるAβ陽性を判定する可能性を示している。このようなアッセイはさらなる検証が必要であり、特に、頑健性に潜在的な問題があるため、血漿Aβ42/40比が臨床診断にタイムリーな支援を提供するのに十分なスケーラビリティを持つかどうかを理解する必要がある。血漿pTau181、pTau217、pTau231は、進行するタウ関連AD病理の検出に有望であることが示されている。さらに、血中GFAPは、MCI患者におけるAD dementiaへの認知機能低下を予測し、FTDとADを鑑別する可能性を示している。
ある研究では、NfLがコントロールと比較して原発性進行性失語症患者の血漿中で増加し、nfPPA/svPPAとlvPPAを感度81%、特異度67%で識別することが示されている。将来的には、BBBMはADの発見において有用なトリアージツールとなり、適切な患者がタイムリーに神経認知評価と確認的バイオマーカー検査を受けられるようになるだろう。バイオマーカープロファイルは臨床評価に完全に取って代わることはできない。したがって、BBBMは、臨床的意思決定を支援するために病歴や画像診断と併せて用いられるツールとなる可能性が高い。
アポリポ蛋白E (APOE) は血液ベースの遺伝子バイオマーカーであり、APOEε4遺伝子型はADの危険因子である。症候性ADへの進行リスクを増加させる要因のひとつは、APOE ε4遺伝子保有の有無であり、APOE ε4ホモ接合体は臨床的AD発症リスクが非常に高い。従って、ADと一致する症状を有する人にAPOE ε4が存在することは、アミロイド病理の可能性が高いことを裏付けている。(non-APOE遺伝子の寄与を決定するために) APOE領域を除外した多遺伝子リスクスコアとAPOEステータスを併用することは、認知症リスクの高い個人を同定するための最良の戦略を提供するかもしれない。臨床的表現型に関しては、典型的な健忘型表現型はAPOE ε4対立遺伝子によって促進されるが、非典型的な非健忘型表現型はAPOE ε4対立遺伝子がない場合にしばしば起こる。
8. バイオマーカーはAD診断の臨床評価に関する補完的役割を持つべきである
伝統的に、ADの診断は臨床基準のみに基づいて行われていた。しかしAD診断の現行のガイドラインは、バイオマーカーの存在も考慮している。バイオマーカーを用いた神経病理学的なAD診断のためには、NIA-AAの"ATN"研究フレームワークを用いることができる。このフレームワークは、臨床表現型や認知症状の有無にかかわらず、アミロイド異常 ('A')、タウ蛋白変化 ('T')、神経変性のエビデンス ('N') に基づいてADを定義することを提唱した。ATN研究フレームワークガイドラインは、神経病理学者は脳内AD病理の存在を確認できるが、ADとして認識されている臨床病理学的症候群を診断することはできないと結論付けた。
NIA-AAの"ATN"研究フレームワークの利用は、研究目的である。このため、臨床現場でこのフレームワークを用いることに関する議論は存在する。バイオマーカー単独ではADの診断をつけるにあたって十分ではなく、これは臨床診断をサポートして確認するための臨床評価の補助として用いられるべきである。タウPETは認知的に正常な個人における認知機能低下を予測することが示されているが、アミロイド陽性でも生涯にわたって臨床症状を呈さない個人もいることから、認知的に正常な個人においてバイオマーカーのみに基づいてADと診断することは一般的にそこまで高い診断的精度を持たない。アミロイド陽性の認知的に正常な個人における生涯にわたる認知症のリスクの現時点での推定は、44-74%とされている。タウPETとCSFによるタウの測定は、生物学的にも臨床的進行の観点からも、直接比較できるものではないことに注意することが重要である。上述したように、一般的にタウの変化の存在は、より急速な進行の指標である。さらに、臨床評価なし、あるいは臨床症状なしには、バイオマーカーに基づくAD診断だけでは、カウンセリングを受けていない患者にとって有害である可能性がある。患者は、バイオマーカーが陽性であればADリスク状態であることを認識すべきであり、AD症状が生涯に発現しない可能性があることを認識すべきである。臨床的にADと診断された患者は、バイオマーカー陽性を示さないことがある。臨床的にADと診断された患者の最大35%がアミロイドPET陰性であり、ADの表現型が必ずしも脳内のAD病理を示すものではないことを示している。
バイオマーカーのみによるAD診断のもう一つの大きな限界は、バイオマーカー陽性の患者の間で疾患進行のばらつきが大きいことである。進行のリスクはいくつかの因子に依存し、脳の抵抗性 (i.e. かなりのADリスク因子があるにもかかわらず病理が認められないか低いレベルであること)、回復力 (i.e. AD病理が高いレベルであるにもかかわらず認知機能が正常であること)、予備能 (i.e. 生理的な病前能力) などの複数のメカニズムに関連する可能性がある。生涯を通じて認知機能が正常であり、アミロイドーシスなどのAD病理が剖検時または生体画像でのみ認められる人はかなりの割合で存在する (約30%)。
多くの認知症は混合病理を有しており、AD以外の病理学的変化に対するバイオマーカーがほとんど利用できないことから、AD以外の認知症を同定することは困難である。鑑別診断は、表現型または死後検査に大きく依存する。専門家の間でも、ADの臨床的判定に対する診断精度は約75-80%である。しかし、CSFバイオマーカー (Aβ42、pTau181、tTau) だけで、non-AD dementiaとADを82.7%の診断精度で鑑別することができ、これは神経画像診断を含む徹底的な臨床検査に基づく81.6%の臨床診断精度に匹敵する。さらに、アミロイドPETとタウPETは、ADと前頭側頭葉変性症を鑑別する能力を実証している。アミロイドPETとタウPETは、ADでは陽性、AD以外の疾患では陰性である。ADの異なる表現型の鑑別診断の可能性を表2にまとめた。

表2. ADの異なる表現型の鑑別診断の可能性
"ATN"研究フレームワークがADの診断で考慮されるバイオマーカーのレパートリーのごく一部しかカバーできていないことを覚えておかなければならない。フレームワークに含めることが考慮される他のバイオマーカーには、NfL (神経変性)、β-synuclein (シナプス変性)、GFAP (アストログリオーシス)、炎症バイオマーカーがある。
9. 臨床的意思決定をサポートするバイオマーカー
ADのバイオマーカーは、臨床的な意思決定において確認的な役割を果たすが、これは抗Aβ DMTの進歩に伴い特に重要となっている (図4)。これらのDMTは、認知機能変化の発症を遅らせたり、進行を遅らせたりすることを目的としているため、疾患経過の早期介入が望まれる。ADの基礎となる病態を同定することにより、バイオマーカーは早期診断に役立ち、場合によっては臨床症状が現れる前にADリスクのある患者を特定できる可能性がある。臨床で確立されているADバイオマーカーには、MRI、FDG-PET、タウPET、CSFアミロイドとタウ、血液バイオマーカーがあり、これらは承認されつつある。
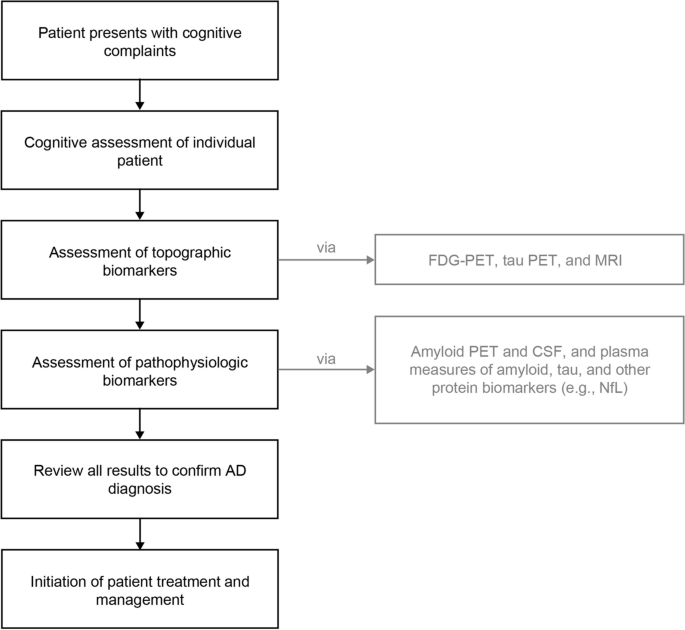
図4. 臨床現場におけるADバイオマーカーの役割
臨床現場におけるバイオマーカーの利用は、AD患者やリスク状態にある個人に対する創薬の助けになるだろう。たとえば、APOE ε4ホモ接合体はpreclinical ADの研究や臨床試験におけるハイリスク集団に該当する。APOE ε4ステータスがADの臨床診断の重要な役割を持つようになるとは考えにくいが、APOE ε4評価は、キャリアにおけるARIAの発生率が高いことから、抗Aβ DMTが利用可能になるにつれ重要になるだろう。アミロイドPETは、ADの診断の補助となるアミロイドプラーク負荷の定量的測定法であるため、研究や臨床試験における患者の効率的かつ客観的な分類に有用である。しかし、この手法はコストや利用可能性の点で未だ臨床現場では有用性が低いかもしれない。血漿pTau181は、最近の研究で認知機能障害のない個人から症候性ADへの移行を正確に予測することが実証されたことから、臨床試験において価値があるかもしれない。血漿pTau217は、疾患モニタリングや臨床試験における参加者選択に有用かもしれない。さらに、FDG-PETはMCI患者におけるADの進行を予測することができる幅広く利用可能なツールであるかもしれず、また疾患進行のない時間を推定するために用いることができるかもしれない。
バイオマーカーは、生体内における健忘型ADと非健忘型ADの両方の表現型の検出を容易にする。非典型的なAD臨床症候群を呈する患者は、典型的なAD患者よりも診断が遅れることが多い。ある研究では、若年発症のAD患者において、典型的な患者 (4%) と比較して、非典型的な患者 (53%) では誤診が一般的であったことが示されている。ADバイオマーカーが利用可能になり、診断アルゴリズムに非典型的ADの表現型が組み込まれることで、これらの患者を疾患経過の早い段階でより確実に同定・診断することができるようになり、その結果、患者に合わせた情報提供、適切なケアとサポート、個別の治療計画の構築が可能になる。患者やその家族に予後を知らせることには価値があり、患者は診断に適応する方法を学び、入手可能な情報に基づいて選択や計画を立てることができるからである。これらの進歩により、非典型的表現型の患者を除外することが多いDMTの臨床試験へのアクセスが改善されるであろう。
10. 結論
ADの非典型的な病像はしばしば他の認知症サブタイプを模倣し、ADバイオマーカーを用いることで鑑別診断が容易になる。ADバイオマーカー単独では、ADの診断やAD認知症への進展の予測に十分ではない。バイオマーカーは、ADの診断に役立つ臨床評価を補完するものであるべきである。患者は、ADの多様な性質と進行、および無症状の人のバイオマーカー陽性結果が生涯のうちにAD症状が出現することを予測できない可能性を理解すべきである。ADバイオマーカーの使用と、診断基準におけるADの非典型的表現型の認識の向上により、誤診され不適切な治療を受けていたであろう非典型的臨床像を呈する患者の早期診断が可能になる。早期診断は、適切な情報提供、適切なケアとサポート、個別化された治療を行うために不可欠である。DMTがADの基礎病理に影響を与えることが期待されているため、患者のAD表現型を特徴づけることは、治療アプローチや介入効果の評価を導く上で重要な要素となる。
感想
広く浅くって感じの総説だな...。もうちょっと狭く深い総説を探してみよう。